Beriate Trockensubstanz 1000 Ie C Solv + Set Durchstechflasche
Beriate Trockensub 1000 IE mit Solvens und Verabreichungsset Dur
-
163092.48 RUB

- Наличие: Нет в наличии
- Производитель: CSL BEHRING AG
- Модель: 7756787
- ATC-код B02BD02
- EAN 7680548240057
Описание
Zusammensetzung
Wirkstoffe
Blutgerinnungsfaktor VIII aus Humanplasma.
Hilfsstoffe
Glycin, Saccharose, Natriumchlorid (entspricht 2,3 mg/ml Natrium bzw. 11,5 mg pro 500 I.E. und 23 mg pro 1000 I.E.), Calciumchlorid
Darreichungsform und Wirkstoffmenge pro Einheit
Beriate besteht aus einem weissen Pulver (Lyophilisat) und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung zur intravenösen (i.v.) Anwendung.
500/1000 I.E. Blutgerinnungsfaktor VIII aus Humanplasma.
Nach Rekonstitution mit 5 / 10 ml enthält Beriate 100 I.E. / ml Faktor VIII.
Die Aktivität (I.E.) wird mittels chromogenem Test gemäss Europäischem Arzneibuch bestimmt. Die mittlere spezifische Aktivität von Beriate beträgt ca. 400 I.E. / mg Protein.
Indikationen/Anwendungsmöglichkeiten
- Therapie und Prophylaxe von Blutungen bei angeborenem (kongenitalem) Faktor VIII-Mangel (Hämophilie A).
- Das Produkt kann in der Behandlung des erworbenen Faktor VIII-Mangels eingesetzt werden.
- Beriate enthält von-Willebrand-Faktor in pharmakologisch unwirksamen Mengen und kann deshalb beim von-Willebrand-Jürgens-Syndrom nicht eingesetzt werden.
Dosierung/Anwendung
Die Therapie soll unter Aufsicht eines in Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Übliche Dosierung
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor VIII-Mangels, nach Ausmass und Ort der Blutung und nach dem klinischen Zustand des Patienten.
Die Menge des verabreichten Faktor VIII wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor VIII-Produkte entsprechen. Die Faktor VIII-Aktivität im Plasma wird entweder als Prozentsatz (bezogen auf das normale Humanplasma) oder in I.E. (bezogen auf den Internationalen Standard für Faktor VIII im Plasma) angegeben. Eine I.E. Faktor VIII-Aktivität entspricht dem Faktor VIII-Gehalt von 1 ml normalem Humanplasma.
Die Berechnung der benötigten Faktor VIII-Dosierung basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor VIII pro kg Körpergewicht die Faktor VIII-Aktivität im Plasma um ca. 2% (2 I.E. / dl) der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Initialdosis: Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor VIII-Anstieg (% oder I.E. / dl) x 0,5.
WICHTIG:
Die zu verabreichende Menge sowie die Häufigkeit der Gaben sollten sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Bei den folgenden Blutungsereignissen sollte die Faktor VIII-Aktivität im Plasma (in % der Norm oder I.E. / dl) im entsprechenden Zeitraum nicht unterschritten werden:
Die folgende Tabelle dient als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
Schweregrad der Blutung / Art des chirurgischen Eingriffes | Benötigter Faktor VIII-Mangel (% oder I.E./dl) | Häufigkeit der Dosierung (Stunden)/Dauer der Behandlung (Tage) |
|---|---|---|
Blutung | ||
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle | 20 bis 40 | Wiederholung der Infusion alle 12 bis 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluss der Wundheilung |
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome | 30 bis 60 | Wiederholung der Infusion alle 12 bis 24 Stunden für 3 bis 4 Tage, oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
Lebensbedrohliche Blutungen: | 60 bis 100 | Wiederholung der Infusion alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes |
Chirurgische Eingriffe | ||
Kleinere Eingriffe einschliesslich Zahnextraktionen | 30 bis 60 | Alle 24 Stunden, mind. 1 Tag, bis Abschluss der Wundheilung |
Grössere Eingriffe | 80 bis 100 (prä- und postoperativ) | Wiederholung der Infusion alle 8 bis 24 Stunden bis zum adäquaten Abschluss der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor VIII-Aktivität von 30% bis 60% (I.E./dl) |
Bei der Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie A betragen die üblichen Dosen 20 bis 40 I.E. Faktor VIII/kg Körpergewicht in Intervallen von 2 bis 3 Tagen. In manchen Fällen, besonders bei jungen Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein. Während der Behandlung sollten die Faktor VIII-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern. Vor allem bei grösseren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor VIII-Aktivität im Plasma) der Substitutionstherapie unerlässlich. Einzelne Patienten können in ihrem Ansprechen auf Faktor VIII variieren, wobei unterschiedliche Werte der In-vivo-Recovery erreicht und unterschiedliche Halbwertszeiten gesehen werden.
Die Patienten sollen bezüglich einer Entwicklung von Hemmkörpern gegen Faktor VIII überwacht werden.
Zuvor unbehandelte Patienten
Die Sicherheit und Wirksamkeit von Beriate bei zuvor unbehandelten Patienten wurde bisher nicht untersucht.
Um die Rückverfolgbarkeit von biotlogischen Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Kinder und Jugendliche
Die Dosierung bei Kindern richtet sich nach dem Körpergewicht und deshalb generell nach den gleichen Richtlinien wie für Erwachsene. Die Häufigkeit der Anwendung soll sich stets an der klinischen Wirksamkeit im Einzelfall orientieren. Erfahrungen in der Behandlung von Kindern >6 Jahren liegen vor. Daten zur Behandlung von 16 Kindern jünger als 6 Jahre liegen vor. Die vorliegenden Ergebnisse zur klinischen Wirksamkeit und Sicherheit waren in Übereinstimmung mit den Daten bei älteren Patienten.
Art der Anwendung
Das Auflösen von Beriate erfolgt wie im Kapitel «Sonstige Hinweise, Hinweise für die Handhabung» beschrieben. Beriate soll langsam intravenös mit einer maximalen Infusionsgeschwindigkeit von 2 ml pro Minute verabreicht werden.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Vorsicht ist geboten bei Patienten mit bekannten allergischen Reaktionen auf Bestandteile des Präparates. Bei bekannter allergischer Diathese sollten Antihistaminika und Kortikosteroide prophylaktisch verabreicht werden.
Bei Auftreten von allergisch-anaphylaktischen Reaktionen sollte die Anwendung des Präparates sofort abgebrochen werden. Die aktuellen medizinischen Richtlinien zur Schocktherapie sind zu beachten (vgl. auch Kapitel «Unerwünschte Wirkungen»).
Beriate enthält geringe Mengen an Blutgruppen-Isoagglutininen. Dies hat keine klinische Relevanz, solange die üblichen Dosierungen bei der Therapie leichter oder mittelschwerer Blutungen gewählt werden. Wenn häufige oder sehr hohe Einzelgaben verabreicht werden, sollten jedoch Patienten mit Blutgruppen A, B bzw. AB auf Zeichen der Hämolyse bzw. auf sinkende Hämatokrit-Werte überwacht werden.
Inhibitoren
Die Bildung neutralisierender Antikörper (Hemmkörper) gegen Faktor VIII ist eine bekannte Komplikation bei der Behandlung von Hämophilie A-Patienten. Diese Hemmkörper sind gewöhnlich IgG Immunglobuline, die sich gegen die Faktor VIII-Gerinnungsaktivität richten. Sie werden mittels modifiziertem Test in Bethesda-Einheiten (BE) pro ml Plasma quantifiziert. Das Risiko der Bildung von Hemmkörpern korreliert mit der Aufnahme von antihämophilem Faktor VIII, wobei das Risiko in den ersten 20 Tagen nach Exposition am höchsten ist. In seltenen Fällen entwickeln sich Hemmkörper nach den ersten 100 Tagen. Fälle von wiederkehrenden Inhibitoren (mit niedrigem Inhibitortiter/Inhibitorspiegel) wurden nach Umstellen von einem FVIII-Produkt zu einem anderen bei zuvor behandelten Patienten beobachtet, die eine Inhibitorentwicklung in der Vorgeschichte haben. Deshalb wird empfohlen, alle Patienten nach jedem Wechsel des Produktes sorgfältig auf das Auftreten von Inhibitoren zu beobachten. Grundsätzlich sollten alle Patienten, die mit Gerinnungsfaktor VIII vom Menschen behandelt wurden, durch geeignete klinische Beobachtung und Labortests sorgfältig bezüglich der Entwicklung von Hemmkörpern beobachtet werden. Wenn der erwartete Plasmaspiegel der FVIII-Aktivität im Plasma nicht erreicht wird, oder wenn die Blutung nicht mit einer angemessenen Dosis kontrolliert wird, soll ein Test zum Nachweis von FVIII-Inhibitoren durchgeführt werden. Bei Patienten mit hohen Inhibitorspiegeln kann die FVIII-Behandlung unwirksam sein und es sollten andere Behandlungsmöglichkeiten erwogen werden. Die Behandlung solcher Patienten soll von Ärzten, die in der Therapie von Hämophilie A-Patienten und Patienten mit FVIII-Inhibitoren erfahren sind, durchgeführt werden (siehe auch Kap. «Unerwünschte Wirkungen»).
Beriate kann nicht zur Therapie des von Willebrand-Syndroms angewendet werden, da hier keine Wirkung zu erwarten ist.
Virale Sicherheit
Beriate wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung / Eliminierung von Viren im Herstellverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht vollständig ausgeschlossen werden. Dasselbe gilt auch für bislang unbekannte Viren oder neu aufgetretene Viren und andere Pathogene.
Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren, wie z.B. humane Immundefizienzvirus (HIV), das Hepatitis B-Virus (HBV) und das Hepatitis C-Virus (HCV) sowie für nicht-umhüllte Viren wie Hepatitis A (HAV) oder Parvovirus B 19.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma einschliesslich Faktor VIII Präparate erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmassnahmen gelten für Erwachsene und für Kinder.
Beriate 500 I.E. enthält weniger als 1 mmol Natrium (23 mg) pro Durchstechflasche, das heisst, es ist nahezu «natriumfrei».
Beriate 1000 I.E. enthält 23 mg Natrium pro Durchstechflasche, entsprechend 1,4% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Interaktionen
Es sind keine Studien zu Wechselwirkungen von Faktor VIII mit anderen Arzneimitteln durchgeführt worden.
Schwangerschaft/Stillzeit
Mit Beriate sind keine Reproduktionsstudien an Tieren durchgeführt worden. Aufgrund des seltenen Vorkommens der Hämophilie A bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor VIII während der Schwangerschaft und Stillzeit vor. Das Präparat darf einer schwangeren Frau oder in der Stillzeit nur dann verabreicht werden, wenn eine klare Indikation besteht.
Fertilität
Es liegen keine Daten zur Fertilität vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Beriate hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Angioödem,
Brennen und Stechen an der Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte Urtikaria, Kopfschmerzen, quaddelartiger Nesselausschlag, Hypotonie, Lethargie, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Zittern, Erbrechen und Stridor miteinschliessen können) wurden sehr selten beobachtet und können sich in manchen Fällen zu schwerer Anaphylaxie (einschliesslich Schock) entwickeln.
Patienten mit Hämophilie A können neutralisierende Antikörper (Hemmkörper) gegen Faktor VIII entwickeln (vgl. Kap. «Warnhinweise und Vorsichtsmassnahmen»). Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen.
Die im Folgenden genannten Nebenwirkungen beruhen auf Analysen von postmarketing Daten sowie der wissenschaftlichen Literatur.
Die unten aufgeführte Liste entspricht der MedDRA Systemorganklassifikation.
Die folgenden Standard-Kategorien von Häufigkeiten werden verwendet:
sehr häufig (≥ 1/10), häufig (≥ 1/100 und <1/10); gelegentlich (≥ 1/1000 und <1/100); selten (≥ 1/10'000 und <1/1000); sehr selten (<1/10'000).
Beschreibung ausgewählter Nebenwirkungen
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Faktor VIII Inhibitoren.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr selten: Fieber.
Erkrankungen des Immunsystems
Sehr selten: Überempfindlichkeitsreaktionen (allergische Reaktionen).
Informationen zum Infektionsrisiko siehe auch Kapitel «Warnhinweise und Vorsichtsmassnahmen».
Kinder und Jugendliche
Es wird erwartet, dass die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern denen bei Erwachsenen entspricht.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bisher wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor VIII vom Menschen beobachtet.
Eigenschaften/Wirkungen
ATC-Code
B02BD02
Pharmakotherapeutische Gruppe Antihämorrhagika, Blutgerinnungsfaktor VIII.
Beriate wird aus gepooltem, humanem Plasma gesunder Spender gewonnen. Informationen über die Testung der Spenden und Plasmapools sind unter Kapitel «Warnhinweise und Vorsichtsmassnahmen» beschrieben.
Der Herstellungsprozess von Beriate beinhaltet verschiedene Schritte, die zur Eliminierung/Inaktivierung von Viren beitragen. Dazu gehören ein chromatographisches Verfahren, ein Fällungsschritt, ein Adsorptionsschritt und Hitzebehandlung des Präparates in wässriger Lösung bei 60 °C über 10 Stunden.
Durch einen speziellen Reinigungsschritt werden Blutgruppen-Isoagglutinine und Fibrinogen (Methode nach Clauss) weitestgehend entfernt.
Wirkung
Beriate ist ein spezifisches blutstillendes Mittel zur intravenösen Anwendung bei angeborenem Blutgerinnungsfaktor VIII-Mangel.
Wirkungsmechanismus
Der Faktor VIII-/von-Willebrand-Faktor Komplex besteht aus zwei Untereinheiten (Faktor VIII und von-Willebrand-Faktor), die unterschiedliche physiologische Wirkungen besitzen. Bei der Behandlung hämophiler Patienten, bindet Faktor VIII an von-Willebrand-Faktor im Blutkreislauf des Patienten.
Aktivierter Faktor VIII agiert als Kofaktor für den aktivierten Faktor IX und beschleunigt so die Umwandlung von Faktor X in aktivierten Faktor X. Aktivierter Faktor X wandelt Prothrombin in Thrombin um. Thrombin wandelt dann Fibrinogen in Fibrin um, und ein Gerinnsel kann gebildet werden. Hämophilie A ist eine geschlechtsgebunden vererbte Störung der Blutgerinnung, die auf einem Mangel an Faktor VIII:C beruht. Als Folge davon treten spontane oder verletzungsbedingte oder bei chirurgischen Eingriffen hervorgerufene Blutungen in Gelenken, Muskeln oder inneren Organen auf. Durch Substitutionstherapie werden die Faktor VIII-Plasmaspiegel angehoben und dadurch eine vorübergehende Korrektur des Faktor VIII-Mangels sowie eine Behebung der Blutungsneigungen herbeigeführt.
Zusätzlich zu seiner Funktion als Faktor VIII stabilisierendes Protein vermittelt von Willebrand Faktor die Anlagerung der Thrombozyten an den verletzten Gefässendothelien und spielt die Hauptrolle bei der Thrombozytenaggregation.
Pharmakokinetik
Absorption und Distribution
Das Präparat wird intravenös appliziert. Der Anstieg der Faktor VIII-Aktivität nach Gabe von 1 I.E. Faktor VIII pro kg Körpergewicht (inkrementelle Wiederfindungsrate) betrug ungefähr 2% mit einer intraindividuellen Variabilität von 1,5 - 3%.
Elimination
Die Faktor VIII-Aktivität nimmt mono oder bi-exponentiell ab. Die terminale Halbwertszeit variiert zwischen 5 und 22 Stunden, mit einem Mittel von ca. 12 Stunden. Die mittlere Verweildauer war 17 Stunden (SD 5,5 Stunden).
Die mittlere AUC betrug 0,4 h x kg / ml (SD 0,2), die mittlere Clearance 3 ml / h / kg (SD 1,5 ml / h / kg).
Kinder und Jugendliche
Es wurden keine pharmakokinetischen Studien bei Kindern durchgeführt.
Präklinische Daten
Toxizitätsuntersuchungen mit wiederholten Dosen wurden wegen der Antikörperbildung gegen heterologes Protein nicht durchgeführt.
Sogar das Mehrfache der empfohlenen menschlichen Dosis pro kg Körpergewicht zeigt bei Untersuchungen an Labortieren keine Toxizität. Die Prüfungen des hitzebehandelten F VIII-Präparates mit polyklonalen präzipitierenden Antikörpern (Kaninchen) im Ouchterlony-Test und in der passiven kutanen Anaphylaxie am Meerschweinchen zeigten im Verhältnis zu unbehandeltem Protein keine veränderten immunologischen Reaktionen. Da klinische Erfahrung keinen Hinweis auf onkogene und mutagene Wirkungen des Gerinnungsfaktors VIII gibt, sind experimentelle Untersuchungen, besonders an heterologen Spezies, nicht notwendig.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Ausgenommen davon ist das unter «Galenische Form und Wirkstoffmenge pro Einheit» angegebene Lösungsmittel.
Haltbarkeit
Beriate darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden. Aus mikrobiologischer Sicht und da Beriate kein Konservierungsmittel enthält, sollte das gelöste Präparat unmittelbar nach Anbruch verwendet werden.
Haltbarkeit nach Anbruch
Die chemische und physikalische Gebrauchsstabilität des rekonstituierten Produktes wurde für 8 Stunden bei 25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Wenn es nicht sofort verabreicht wird, darf eine Lagerung in der Durchstechflasche 8 Stunden bei Raumtemperatur nicht überschreiten. Sobald das Produkt in die Spritze aufgezogen wurde, sollte es sofort verwendet werden.
Besondere Lagerungshinweise
Arzneimittel für Kinder unzugänglich aufbewahren.
Beriate ist im Kühlschrank (2 – 8 °C) und vor Licht geschützt (in der Originalverpackung) zu lagern. Präparat nicht einfrieren.
Beriate kann innerhalb der Haltbarkeitsdauer einmalig bis max. 1 Monat bei Raumtemperatur (max. 25 °C) gelagert werden.
Hinweise für die Handhabung
Die Lösung sollte klar und leicht opaleszent sein. Gelegentlich können einige Flocken oder Partikel in der Durchstechflasche auftreten. Der im «Mix2vial™» Transferset enthaltene Filter entfernt diese Partikel. Die Dosierungsberechnung wird durch diese Filtrierung nicht beeinflusst. Nach dem Filtrieren und Aufziehen (siehe unten) des rekonstituierten Produktes in die Einwegspritze sollte das Produkt in der Spritze vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden.
Verwenden Sie keine Lösungen, die trüb sind oder Rückstände in der Spritze enthalten (Ablagerungen / Partikel). Sobald das Produkt in die Spritze aufgezogen wurde, sollte es sofort verwendet werden. Lagern Sie das Produkt nicht in der Spritze.
Zubereitung und Entnahme müssen unter aseptischen Bedingungen erfolgen.
Zubereitung:
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Vor dem Öffnen der Transferset-Packung («Mix2Vial») die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer antiseptischen Lösung abwischen und anschliessend trocknen lassen.
| 1. Das Deckpapier von der Transfer-Packung «Mix2Vial» entfernen. Das Mix2Vial nicht aus dem Blister entnehmen! |
| 2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das «Mix2Vial» Set mit der Packung greifen und senkrecht mit der blauen Seite auf die Lösungsmittelflasche fest aufstecken. |
| 3. Vorsichtig die Verpackung vom «Mix2Vial» Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur die Packung und nicht das «Mix2Vial» von der Lösungsmittelflasche entfernt wird. |
| 4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über. |
| 5. Mit der einen Hand die Produktseite, mit der anderen Hand auf der Lösungsmittelseite greifen und das Set auseinanderschrauben. Die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter entsorgen. |
| 6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln. |
| 7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden und die Luft in die Produktflasche injizieren. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und das Produkt durch langsames Zurückziehen des Stempels in die Spritze aufziehen. |
Aufziehen der Lösung in die Spritze und Anwendung
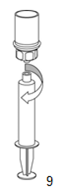
| 8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und das Produkt durch langsames Zurückziehen des Stempels in die Spritze aufziehen. |
| 9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten Mix2Vial Adapter abdrehen. |
Nach der Anwendung sollen ungebrauchtes Produkt oder verbrauchtes Material fachgerecht entsorgt werden.
Zulassungsnummer
54824 (Swissmedic)
Zulassungsinhaberin
CSL Behring AG, Bern
Stand der Information
Mai 2020
Composizione
Principi attivi
Fattore VIII della coagulazione da plasma umano.
Sostanze ausiliarie
Glicina, saccarosio, cloruro di sodio (corrispondente a 2,3 mg/ml di sodio o 11,5 mg per 500 UI e 23 mg per 1000 UI), calcio cloruro
Forma farmaceutica e quantità di principio attivo per unità
Beriate è composto da una polvere bianca (liofilizzato) e un solvente per la preparazione di una soluzione iniettabile per somministrazione endovenosa (EV).
500/1000 UI di fattore VIII della coagulazione da plasma umano.
Dopo ricostituzione con 5/10 ml Beriate contiene 100 UI/ml di Fattore VIII.
L'attività viene determinata (in UI) per mezzo del test cromogenico secondo la farmacopea europea. L'attività media specifica di Beriate è approssimativamente 400 UI/mg di proteina.
Indicazioni/Possibilità d'impiego
- Terapia e profilassi di emorragie in caso di deficienza congenita del fattore VIII (emofilia A).
- Il prodotto può essere utilizzato trattamento della deficienza acquisita di fattore VIII.
- Beriate non contiene fattore di von Willebrand in quantità farmacologicamente efficaci e non può quindi essere utilizzato in caso di sindrome di von Willebrand-Jürgens.
Posologia/Impiego
La terapia deve essere praticata sotto la sorveglianza di un medico esperto nel trattamento dell'emofilia.
Posologia abituale
Il dosaggio e la durata della terapia di sostituzione dipendono dalla gravità della carenza del fattore VIII, dall'ubicazione e dall'entità dell'emorragia e dallo stato clinico del paziente.
Il numero di unità di fattore VIII da somministrare è indicato in unità internazionali (UI), secondo gli standard attuali dell'OMS per i prodotti a base di fattore VIII. L'attività del fattore VIII nel plasma è espressa in percentuale (con riferimento al plasma umano normale) oppure in UI (con riferimento allo standard internazionale per il fattore VIII nel plasma). Una UI di attività del fattore VIII corrisponde al contenuto di fattore VIII di 1 ml di plasma umano normale.
Il calcolo del dosaggio necessario di fattore VIII si basa sul risultato empirico per cui 1 UI di fattore VIII per kg di peso corporeo aumenta l'attività nel plasma del fattore VIII di ca. il 2% (2 UI/dl) dell'attività normale. La dose necessaria si calcola con la seguente formula:
Dose iniziale: Unità necessarie = peso corporeo (kg) x aumento desiderato di fattore VIII (% o UI/dl) x 0,5.
IMPORTANTE:
La quantità da somministrare e la frequenza della somministrazione devono altresì considerare l'efficacia clinica specifica nel singolo paziente.
Nel caso dei seguenti eventi emorragici, l'attività nel plasma del FVIII (in % del normale o in UI/dl) non deve scendere al di sotto del valore indicato per il periodo corrispondente.
La tabella seguente può essere utilizzata come riferimento per il dosaggio in caso di eventi emorragici e interventi chirurgici:
Gravità dell'emorragia/tipo di intervento chirurgico | Livello richiesto di fattore VIII (% o UI/dl) | Frequenza del dosaggio (ore) / durata del trattamento (giorni) |
|---|---|---|
Emorragie | ||
Principio di emartrosi, emorragie muscolari o emorragie della cavità orale | da 20 a 40 | Ripetizione dell'infusione ogni 12-24 ore. Min. 1 giorno, fino alla risoluzione dell'episodio di sanguinamento (indicato dal dolore) o all'avvenuta guarigione della ferita. |
Emartrosi più estesa, emorragie muscolari o ematomi | da 30 a 60 | Ripetizione dell'infusione ogni 12-24 ore per 3-4 giorni o più a lungo, fino alla risoluzione del dolore e della limitazione acuta della mobilità. |
Emorragie potenzialmente letali: | da 60 a 100 | Ripetizione dell'infusione ogni 8-24 ore fino alla risoluzione dello stato potenzialmente letale |
Interventi chirurgici | ||
Chirurgia minore, incluse estrazioni dentali | da 30 a 60 | Ogni 24 ore, min. 1 giorno, fino alla guarigione della ferita |
Chirurgia maggiore | da 80 a 100 (pre e post-operatorio) | Ripetizione dell'infusione ogni 8-24 ore fino all'adeguata cicatrizzazione; successivamente proseguire per almeno altri 7 giorni per mantenere un'attività del fattore VIII del 30-60% (UI/dl) |
Nella profilassi a lungo termine di emorragie in pazienti con emofilia A grave le dosi consuete sono di 20-40 UI di fattore VIII/kg di peso corporeo a intervalli di 2-3 giorni. In alcuni casi, in particolare nei pazienti giovani, possono essere necessari intervalli di dosaggio più brevi o dosi maggiori. Durante il trattamento è necessario determinare il relativo livello di FVIII al fine di regolare la dose da somministrare e la frequenza delle infusioni. Soprattutto in caso di Interventi chirurgici maggiori, è necessario un monitoraggio preciso della terapia di sostituzione in termini di analisi della coagulazione (attività plasmatica del fattore VIII). Singoli pazienti possono rispondere in modo diverso al fattore VIII, presentando valori di recupero in vivo ed emivite differenti.
I pazienti devono essere monitorati al fine di rilevare un eventuale sviluppo di inibitori anti-fattore VIII.
Pazienti precedentemente non trattati
La sicurezza e l'efficacia di Beriate non sono state valutate in pazienti non precedentemente trattati.
Per garantire la tracciabilità dei medicamenti biotecnologici, si raccomanda di prendere nota del nome commerciale e del numero di lotto durante ogni trattamento.
Bambini e adolescenti
Il dosaggio nei bambini si basa sul peso corporeo e quindi, in generale, sulle stesse linee guida indicate per gli adulti. La frequenza di somministrazione deve basarsi sempre sull'efficacia clinica nel singolo caso. Ci sono esperienze nel trattamento di bambini >6 anni. Sono disponibili dati sul trattamento di 16 bambini di età inferiore ai 6 anni. I risultati disponibili sull'efficacia e sicurezza clinica corrispondevano ai dati sui pazienti più anziani.
Modo di somministrazione
Beriate si dissolve con le stesse modalità descritte alla rubrica «Altre indicazioni, indicazioni per la manipolazione». Beriate deve essere somministrato per via endovenosa con una velocità d'infusione massima di 2 ml per minuto.
Controindicazioni
Ipersensibilità al principio attivo o a una qualsiasi delle sostanze ausiliarie secondo la composizione.
Avvertenze e misure precauzionali
Prestare attenzione ai pazienti con reazioni allergiche note ai componenti del preparato. In caso di diatesi allergica nota, somministrare come profilassi antistaminici e corticosteroidi.
All'insorgenza di reazioni di natura allergico-anafilattica l'impiego del preparato deve essere interrotto immediatamente. Sono da rispettarsi le linee guida mediche attualmente in vigore per il trattamento dello shock (cfr. anche rubrica «Effetti indesiderati»).
Beriate contiene quantità minime di isoagglutinine dei gruppi sanguigni. Ciò non ha alcuna rilevanza clinica fintanto che vengono scelti i dosaggi comuni per la terapia di emorragie di entità lieve o media. Tuttavia, se vengono somministrate dosi singole frequenti o molto elevate, i pazienti con gruppi sanguigni A, B o AB devono essere monitorati rispetto a segni di emolisi o riduzione dei valori di ematocrito.
Inibitori
La formazione di anticorpi neutralizzanti (inibitori) contro il fattore VIII è una complicazione nota nell'ambito del trattamento di pazienti con emofilia A. Questi inibitori sono normalmente immunoglobuline IgG rivolte contro l'attività di coagulazione del fattore VIII, e vengono quantificati per ml di plasma tramite test in unità Bethesda (UB) modificato. Il rischio di formazione di inibitori è correlato all'assunzione del fattore antiemofilico VIII: il rischio è maggiore nei primi 20 giorni di esposizione. In casi rari la formazione degli inibitori avviene anche dopo i primi 100 giorni. Nel passaggio da un prodotto a base di FVIII a un altro sono stati osservati casi di riformazione degli inibitori (con titolazione/livello degli inibitori basso) in pazienti precedentemente trattati, con anamnesi di formazione di inibitori. Si raccomanda quindi di monitorare attentamente l'eventuale formazione di inibitori in tutti i pazienti dopo ogni cambio di prodotto. Di base tutti i pazienti trattati con fattore di coagulazione VIII vanno monitorati attentamente tramite adeguata osservazione clinica e analisi di laboratorio in merito allo sviluppo di inibitori. Se non viene raggiunto il livello plasmatico di attività del FVIII previsto, o se non si riesce a controllare l'emorragia con una dose adeguata, eseguire un test per verificare la presenza di inibitori del FVIII. Nei pazienti con livello di inibitori elevato, il trattamento a base di FVIII può risultare inefficace e andranno considerate altre possibilità terapeutiche. Il trattamento di tali pazienti deve essere gestito da medici esperti nella terapia di pazienti con emofilia A e di pazienti con inibitori FVIII (vedi anche rubrica «Effetti indesiderati»).
Beriate non può essere usato per la terapia della sindrome di von Willebrand, dal momento che in tali casi non è previsto nessun effetto.
Sicurezza virale
Beriate è un preparato ottenuto dal plasma umano. Le misure standard per prevenire le infezioni derivanti dall'impiego di medicamenti preparati a partire dal sangue o dal plasma umano includono la selezione dei donatori, lo screening delle singole donazioni e dei pool di plasma per evidenziare eventuali marcatori specifici di infezione, così come l'inclusione di passaggi di produzione efficaci per l'inattivazione/eliminazione di virus. Malgrado ciò, quando vengono somministrati medicamenti preparati a partire dal sangue o dal plasma umano, la possibilità di trasmettere agenti patogeni non può essere totalmente esclusa. Lo stesso vale anche per virus e altri patogeni a oggi sconosciuti o di nuova comparsa.
Le misure intraprese sono considerate efficaci per i virus capsulati come ad es. il virus dell'immunodeficienza umana (HIV), il virus dell'epatite B (HBV) e il virus dell'epatite C (HCV) nonché per i virus non capsulati come il virus dell'epatite A (HAV) o il parvovirus B 19.
Per i pazienti che assumono regolarmente preparati da sangue o plasma umano, inclusi preparati a base di fattore VIII, si consiglia di base una vaccinazione contro l'epatite A e l'epatite B.
Bambini e adolescenti
Le avvertenze e misure precauzionali riportate valgono sia per gli adulti che per i bambini.
Beriate 500 UI contiene meno di 1 mmol di sodio (23 mg) per flaconcino, ovvero è pressoché «privo di sodio».
Beriate 1000 UI contiene 23 mg di sodio per flaconcino, corrispondenti all'1,4% della dose massima giornaliera di sodio di 2 g assunta con l'alimentazione raccomandata dall'OMS per un adulto.
Interazioni
Non sono stati condotti studi sulle interazioni del fattore VIII con altri medicamenti.
Gravidanza/Allattamento
Non sono stati effettuati studi riproduttivi negli animali con Beriate. Sulla base della bassa incidenza dell'emofilia A nelle donne, non si dispone di esperienze sull'utilizzo del fattore VIII durante la gravidanza o l'allattamento. Il preparato può essere somministrato a una donna incinta o in fase di allattamento solo in presenza di chiara indicazione.
Fertilità
Non sono disponibili dati sulla fertilità.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Beriate non ha effetti sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine.
Effetti indesiderati
Reazioni di ipersensibilità o reazioni allergiche (che possono comprendere anche angioedema,
bruciore e sensazione di puntura nella sede di iniezione, brividi, arrossamenti della cute con sensazione di calore, orticaria generalizzata, mal di testa, orticaria localizzata simile a pomfi, ipotensione, letargia, nausea, irrequietezza, tachicardia, sensazione di costrizione al petto, tremore, vomito e stridore) sono state osservate con frequenza non comune e possono, in alcuni casi, evolvere in grave anafilassi (compreso shock).
I pazienti con emofilia A possono sviluppare anticorpi neutralizzanti (inibitori) anti-fattore VIII (cfr. sezione «Avvertenze e misure precauzionali»). In caso di comparsa di tali inibitori, lo stato si manifesta sotto forma di risposta clinica insufficiente. In questi casi si raccomanda di contattare un centro specializzato in emofilia.
Gli effetti collaterali sottoindicati si basano sull'analisi dei dati postmarketing e sulla letteratura scientifica.
L'elenco seguente si basa sulla classificazione sistemica organica MedDRA.
Sono utilizzate le seguenti categorie standard di frequenza:
molto comune (≥ 1/10), comune (≥ 1/100 e <1/10); non comune (≥ 1/1000 e <1/100); raro (≥ 1/10'000 e <1/1000); molto raro (<1/10'000).
Descrizione di alcuni effetti collaterali
Patologie del sistema emolinfopoietico:
Molto raro: inibitori del fattore VIII.
Patologie sistemiche e condizioni relative alla sede di somministrazione:
Molto raro: Febbre.
Disturbi del sistema immunitario:
Molto raro: reazioni di ipersensibilità (reazioni allergiche).
Per informazioni sul rischio di infezione, vedere anche la rubrica «Avvertenze e misure precauzionali».
Bambini e adolescenti
Nei bambini si prevede che la frequenza e la gravità degli effetti collaterali corrispondano a quelle degli adulti.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
A oggi non sono stati osservati sintomi di sovradosaggio con il fattore di coagulazione VIII umano.
Proprietà/Effetti
Codice ATC
B02BD02
Categoria farmacoterapeutica antiemorragici, fattore di coagulazione VIII.
Beriate è ottenuto da pool di plasma umano di donatori sani. Le informazioni sullo screening delle donazioni e dei pool di plasma sono descritte alla rubrica «Avvertenze e misure precauzionali».
Il processo di produzione di Beriate include diverse fasi che contribuiscono all'eliminazione/inattivazione dei virus. Queste comprendono un procedimento cromatografico, una fase di precipitazione, una fase di adsorbimento e termotrattamento del preparato in soluzione acquosa a 60 °C per 10 ore.
Le isoagglutinine dei gruppi sanguigni e il fibrinogeno (metodo secondo Clauss) sono rimossi quanto più possibile tramite una speciale fase di pulizia.
Azione
Beriate è un agente coagulante specifico per la somministrazione endovenosa in caso di carenza congenita del fattore di coagulazione VIII.
Meccanismo d'azione
Il complesso dei fattori VIII/di von Willebrand è composto da due sottounità (F VIII e vWF), dotate di effetti fisiologici diversi. Nel trattamento di pazienti emofiliaci, il fattore VIII si lega al fattore von Willebrand nella circolazione sanguigna del paziente.
Il fattore VIII attivo agisce da co-fattore per il fattore IX attivato velocizzando così la trasformazione del fattore X in fattore X attivato. Il fattore X attivato trasforma la protrombina in trombina. La trombina trasforma poi il fibrinogeno in fibrina e a questo punto si può formare il coagulo. L'emofilia A è un disturbo ereditario della coagulazione genere-dipendente che deriva dalla carenza di fattore VIII:C. Di conseguenza, possono verificarsi forti emorragie in articolazioni, muscoli od organi interni sia di natura spontanea che a seguito di incidenti o interventi chirurgici. Grazie alla terapia di sostituzione è possibile aumentare i livelli plasmatici di fattore VIII ottenendo così una correzione temporanea della carenza di fattore VIII e l'eliminazione della tendenza all'emorragia.
Oltre alla sua funzione di proteina stabilizzante del fattore VIII, il fattore von Willebrand trasmette il legame con i trombociti all'endotelio dei vasi lesionati e gioca un ruolo principale nell'aggregazione dei trombociti.
Farmacocinetica
Assorbimento e distribuzione
Il preparato viene somministrato per via endovenosa. L'aumento dell'attività del fattore VIII dopo la somministrazione di 1 UI di fattore VIII per kg di peso corporeo (tasso di recupero incrementale) era di ca. il 2% con una variabilità intraindividuale di 1,5-3%.
Eliminazione
L'attività del fattore VIII decade mono o bi-esponenzialmente. L'emivita terminale varia tra 5 e 22 ore, con un valore medio di ca. 12 ore.
Il tempo medio di permanenza era di 17 ore (deviazione standard [SD] 5,5 ore) L'AUC media era di 0,4 h x kg/ml (SD 0,2), la clearance media 3 ml/h/kg (SD 1,5 ml/h/kg).
Bambini e adolescenti
Non sono stati eseguiti studi farmacocinetici sui bambini.
Dati preclinici
A causa della formazione di anticorpi contro le proteine eterologhe non sono stati eseguiti studi di tossicità con dosi ripetute.
Non è stata dimostrata nessuna tossicità negli studi di laboratorio sugli animali, neanche somministrando multipli della dose umana raccomandata per kg di peso corporeo. Le analisi del preparato di F VIII trattato termicamente con anticorpi policlonali precipitati (coniglio) nel saggio di Ouchterlony e nell'anafilassi cutanea passiva sui porcellini d'India non hanno evidenziato cambiamenti nelle reazioni immunologiche in confronto alla proteina non trattata. Poiché l'esperienza clinica non ha evidenziato nessuna indicazione di effetti oncogeni e mutageni del fattore di coagulazione VIII, non sono necessari studi sperimentali, in particolare sulle specie eterologhe.
Altre indicazioni
Incompatibilità
Poiché per questo medicamento non sono stati condotti studi di compatibilità, non lo si deve somministrare in combinazione con altri medicamenti. Fa eccezione il solvente indicato in «Forma farmaceutica e quantità di principio attivo per unità».
Stabilità
Beriate non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore. Per ragioni microbiologiche e poiché Beriate non contiene conservanti, il preparato pronto all'uso deve essere utilizzato immediatamente dopo l'apertura.
Stabilità dopo l'apertura
La stabilità chimica e fisica in uso del prodotto ricostituito è stata dimostrata per 8 ore a 25 °C. Per ragioni microbiologiche il prodotto deve essere utilizzato subito. Se non viene somministrato immediatamente, la conservazione nel flaconcino non deve superare le 8 ore a temperatura ambiente. Il prodotto deve essere utilizzato non appena viene aspirato nella siringa.
Indicazioni particolari concernenti l'immagazzinamento
Conservare fuori dalla portata dei bambini.
Beriate deve essere conservato in frigorifero (2 – 8 °C) e al riparo dalla luce (nella confezione originale). Non congelare il preparato.
Entro il termine di conservazione, Beriate può essere conservato a temperatura ambiente (massimo 25 °C) per un periodo non superiore a 1 mese.
Indicazioni per la manipolazione
La soluzione deve risultare trasparente e leggermente opalescente. Occasionalmente possono apparire nel flaconcino fiocchi o particelle, che vengono rimossi dal filtro incorporato nel set di trasferimento «Mix2vial™». Il calcolo del dosaggio non viene influenzato da questa filtrazione. Dopo la filtrazione e l'aspirazione (vedi sotto) del prodotto ricostituito nella siringa monouso, il prodotto nella siringa deve essere esaminato visivamente prima della somministrazione per identificare eventuali particelle e colorazioni anomale.
Non utilizzare soluzioni torbide o contenenti residui nella siringa (depositi/particelle). Il prodotto deve essere utilizzato non appena viene aspirato nella siringa. Non conservare il prodotto nella siringa.
La preparazione e il prelievo devono avvenire in condizioni asettiche.
Preparazione:
Portare il solvente a temperatura ambiente. Rimuovere le ghiere di protezione a strappo dei flaconcini del solvente e del prodotto e disinfettare i tappi con una soluzione antisettica, attendendo che questa sia asciugata, prima di aprire la confezione del set di trasferimento («Mix2Vial»).
| 1. Rimuovere la carta di copertura dalla confezione del trasferimento «Mix2Vial». Non estrarre il Mix2Vial dal blister! |
| 2. Posizionare il flaconcino del solvente su una superficie piana e pulita, tenendolo ben fermo. Afferrare il set «Mix2Vial» con la confezione e inserirlo verticalmente con il lato blu sul flaconcino del solvente. |
| 3. Rimuovere con cura la confezione del set «Mix2Vial» afferrando il blister sul bordo sigillato e tirandolo verticalmente verso l'alto. Prestare attenzione a rimuovere dal flaconcino del solvente solo la confezione e non il «Mix2Vial». |
| 4. Porre il flaconcino del medicamento su un supporto solido. Capovolgere il flaconcino del solvente con il set Mix2Vial inserito e spingere la punta dell'adattatore trasparente verticalmente attraverso il tappo del flaconcino del prodotto. Il solvente fluirà automaticamente nel flaconcino contenente il prodotto. |
| 5. Con una mano afferrare il lato con il prodotto, con l'altra afferrare il lato con il solvente e svitare il set. Smaltire il flaconcino del solvente con l'adattatore blu Mix2Vial. |
| 6. Ruotare delicatamente il flaconcino del prodotto con l'adattatore trasparente fino a quando il prodotto non sarà completamente sciolto. Non agitare! |
| 7. Aspirare aria in una siringa vuota, sterile. Tenendo il flaconcino del prodotto in posizione verticale, collegare la siringa al raccordo Luer Lock del set Mix2Vial e iniettare aria nel flaconcino. Mantenendo premuto lo stantuffo della siringa, capovolgere il dispositivo e aspirare il prodotto nella siringa tirando indietro lo stantuffo lentamente. |
Aspirazione della soluzione nella siringa e somministrazione
| 8. Mantenendo premuto lo stantuffo della siringa, capovolgere il dispositivo e aspirare il prodotto nella siringa tirando indietro lo stantuffo lentamente. |
| 9. Dopo aver completamente trasferito la soluzione nella siringa, afferrare il cilindro (tenendo lo stantuffo in posizione) e svitare la siringa dall'adattatore trasparente del Mix2Vial. |
Dopo la somministrazione il prodotto non utilizzato o il materiale usato devono essere smaltiti come previsto.
Numero dell'omologazione
54824 (Swissmedic)
Titolare dell’omologazione
CSL Behring AG, Berna
Stato dell'informazione
Maggio 2020
Composition
Principe actif
Facteur de coagulation VIII de plasma humain.
Excipients
Glycine, saccharose, chlorure de sodium (correspondant à 2,3 mg/ml de sodium resp. 11,5 par U.I. et 23 mg par 1000 U.I.), chlorure de calcium.
Forme pharmaceutique et quantité de principe actif par unité
Beriate se compose d'une poudre blanche (lyophilisat) et d'un solvant pour la préparation d'une solution injectable ou pour perfusion en vue d'une administration par voie intraveineuse (i.v.).
500/1000 U.I. de facteur de coagulation VIII de plasma humain.
Après reconstitution avec 5/10 ml, Beriate contient 100 U.I./ml de facteur VIII.
L'activité (U.I.) est déterminée par un test chromogénique selon la Pharmacopée Européenne. L'activité spécifique moyenne de Beriate est d'environ 400 U.I./mg de protéine.
Indications/Possibilités d’emploi
- Thérapie et prophylaxie des hémorragies chez les patients atteints de déficience congénitale en facteur VIII (hémophilie A).
- Le produit peut être utilisé lors de déficience acquise du facteur de coagulation VIII.
- Beriate ne contient pas de facteur de von Willebrand en quantité pharmacologiquement active; par conséquent, il ne peut être utilisé pour traiter le syndrome de von Willebrand-Jürgens.
Posologie/Mode d’emploi
Le traitement ne peut être instauré que sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie.
Posologie
La posologie et la durée du traitement de substitution dépendent de la gravité du déficit en facteur VIII, de la sévérité et de la localisation du saignement ainsi que de l'état clinique du patient.
La dose de facteur VIII administrée est exprimée en Unités Internationales (U.I.), ramenées au standard de l'OMS pour les concentrés de facteur VIII. L'activité en facteur VIII dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain), soit en U.I. (par rapport au Standard International du facteur VIII plasmatique). Une U.I. de facteur VIII correspond à la teneur en facteur VIII dans 1 ml de plasma humain normal.
Le calcul de la posologie de facteur VIII nécessaire se base sur le résultat empirique, selon lequel une U.I. de facteur VIII/kg de poids corporel augmente l'activité du facteur VIII d'environ 2% (2 U.I./dl) dans le plasma par rapport à l'activité normale. La dose nécessaire est déterminée selon la formule suivante:
Dose initiale: Unités nécessaires = poids corporel (kg) × élévation souhaitée du facteur VIII (% ou U.I./dl) × 0,5.
IMPORTANT:
Dans chaque cas, on orientera la posologie et la durée du traitement en fonction de l'efficacité clinique.
Dans les situations suivantes d'hémorragie, l'activité plasmatique du facteur VIII (en % par rapport à la norme ou en U.I./dl) ne devrait pas s'abaisser au-dessous des valeurs indiquées, durant la période correspondante:
Le tableau ci-dessous peut servir de guide pour les posologies lors d'épisodes hémorragiques et interventions chirurgicales.
Importance de l'hémorragie/type d'intervention chirurgicale | Taux nécessaire de déficience en facteur VIII (% ou U.I./dl) | Fréquence de posologie (heures)/durée de traitement (jours) |
Hémorragies | ||
Hémarthroses précoces, saignements musculaires ou saignements dans la cavité buccale | 20 à 40 | Répéter les perfusions toutes les 12 à 24 heures pendant au moins 1 jour, jusqu'à la fin de l'épisode hémorragique (indiquée par la disparition de la douleur) ou jusqu'à la cicatrisation complète |
Hémarthroses plus étendues, saignements musculaires ou hématomes | 30 à 60 | Répéter les perfusions toutes les 12 à 24 heures pendant 3 à 4 jours, ou plus longtemps, jusqu'à la disparition de la douleur et des restrictions de l'appareil locomoteur |
Hémorragies susceptibles de mettre la vie en danger | 60 à 100 | Répéter les perfusions toutes les 8 à 24 heures jusqu'à ce que le patient soit hors de danger |
Interventions chirurgicales | ||
Interventions mineures y compris avulsion de dents | 30 à 60 | Toutes les 24 heures pendant au moins 1 jour, jusqu'à la cicatrisation complète |
Interventions majeures | 80 à 100 (pré- et postopératoire) | Répéter les perfusions toutes les 8 à 24 heures jusqu'à la cicatrisation adéquate complète, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir un taux d'activité de facteur VIII entre 30% et 60% (U.I./dl) |
Comme mesure prophylactique à long terme des hémorragies chez les patients atteints d'hémophilie A grave, les doses usuelles sont de 20 à 40 U.I. de facteur VIII par kg de poids corporel, à des intervalles de 2 à 3 jours. Dans certains cas, et surtout chez les patients jeunes, des intervalles de traitement plus courts et des doses plus élevées peuvent être nécessaires. Au cours du traitement, il est conseillé d'effectuer une détermination appropriée des taux de facteur VIII plasmatique pour régler la dose à administrer et la fréquence des injections. Une surveillance rigoureuse de l'hémostase et de la coagulation (activité plasmatique du facteur VIII) est indispensable lors de thérapie de substitution, surtout en cas d'intervention chirurgicale majeure. La réponse des patients au facteur VIII peut varier, entraînant différents taux de récupération in vivo et différentes demi-vies.
Le développement d'inhibiteurs contre le facteur VIII doit être régulièrement surveillé chez les patients.
Patients non traités antérieurement
La sécurité et l'efficacité de Beriate sur des patients non traités antérieurement n'a pas été étudiée jusqu'à présent.
Afin d'assurer la traçabilité des médicaments biologiques, il est recommandé d'enregistrer le nom commercial et le numéro de lot lors de chaque traitement.
Enfants et adolescents
Chez l'enfant, la posologie sera adaptée au poids corporel, en suivant généralement les mêmes directives que chez l'adulte. Dans chaque cas, la fréquence de l'administration doit toujours être adaptée en fonction de l'efficacité clinique. De l'expérience dans le traitement d'enfants âgés de plus de 6 ans a été acquise et l'on dispose aussi de données de traitement pour 16 enfants de moins de 6 ans. Les résultats disponibles sur l'efficacité clinique et la sécurité étaient en concordance avec les données groupant les patients plus âgés.
Mode d'emploi
Reconstituer Beriate comme décrit dans le chapitre «Remarques particulières» (cf. «Remarques concernant la manipulation»). Beriate doit être administré lentement par voie intraveineuse. La vitesse d'administration ne doit pas excéder 2 ml/min.
Contre-indications
Hypersensibilité par rapport au principe actif ou à l'un des excipients selon la composition.
Mises en garde et précautions
La prudence est de rigueur lorsque le patient a des réactions allergiques connues à l'un ou l'autre des composants de la préparation. Les patients à diathèse allergique connue recevront à titre prophylactique des antihistaminiques et des corticostéroïdes.
En cas de réactions allergiques ou anaphylactoïdes, interrompre immédiatement l'administration du produit. En cas de chocs anaphylactiques, observer les standards de la médecine actuelle (voir aussi sous chapitre «Effets indésirables»).
Beriate contient des quantités mineures d'isoagglutinines des groupes sanguins. Cela n'a aucune importance clinique tant que le choix est porté sur les posologies usuelles pour la thérapie d'hémorragies mineures ou moyennes. Il faut cependant faire attention aux signes d'hémolyse et surveiller le taux baissant de l'hématocrite, si l'on administre des doses uniques fréquentes ou élevées à des patients des groupes sanguins A, B resp. AB.
Inhibiteurs
L'apparition d'anticorps neutralisants (inhibiteurs) du facteur VIII est une complication connue dans le traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont habituellement des immunoglobulines IgG dirigées contre l'activité procoagulante du facteur VIII, et sont mesurés en Unités Bethesda par ml de plasma par le test de Bethesda modifié. Le risque de développer des inhibiteurs est corrélé à la durée de l'exposition au facteur VIII – le risque étant le plus élevé au cours des 20 premiers jours d'exposition. Plus rarement, les inhibiteurs peuvent apparaître après les 100 premiers jours d'exposition. Des cas de retour d'inhibiteurs (avec un faible titre/niveau d'inhibiteur) ont été observés lors d'un changement d'un produit FVIII à un autre chez des patients traités antérieurement, présentant des antécédents de développement d'inhibiteurs. Il est dès lors recommandé de surveiller attentivement le développement d'inhibiteurs chez tous les patients après chaque changement de produit. Fondamentalement, tous les patients traités par le facteur de coagulation VIII d'origine humaine doivent être surveillés attentivement eu égard à l'apparition d'inhibiteurs. Si le niveau plasmatique attendu de l'activité du FVIII n'est pas atteint ou lorsqu'une hémorragie n'est pas régulée par une dose appropriée, un test de détection d'inhibiteurs du FVIII doit être réalisé. Chez des patients présentant des niveaux d'inhibiteur élevés, le traitement par le FVIII peut être inefficace et d'autres possibilités de traitement doivent être envisagées. Le traitement de ces patients doit être réalisé par des médecins expérimentés dans la thérapie de patients atteints d'hémophilie A et de patients présentant des inhibiteurs du FVIII (voir également sous chap. «Effets indésirables»).
Beriate ne peut être utilisé pour la thérapie du syndrome de von Willebrand, parce qu'aucun effet n'est à espérer dans ce cas.
Sécurité virale
Beriate est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux.
Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) ainsi que vis-à-vis des virus non-enveloppés tels que le virus de l'hépatite A VHA et le parvovirus B19.
Une vaccination préventive contre l'hépatite A et B sera recommandée aux patients qui reçoivent régulièrement des préparations de sang ou de plasma humain.
Enfants et adolescents
Les mises en garde et précautions s'appliquent aux adultes et aux enfants.
Beriate 500 U.I. contient moins de 1 mmol de sodium (23 mg) par flacon, ce qui signifie qu'il est quasiment exempt de sodium.
Beriate 1000 U.I. contient 23 mg de sodium par flacon, ce qui correspond à 1,4% de l'apport alimentaire quotidien maximal de 2 g recommandé par l'OMS pour un adulte.
Interactions
Aucune étude concernant des interactions du facteur VIII avec d'autres médicaments n'a été effectuée.
Grossesse/Allaitement
A ce jour, aucune examen de reproduction chez l'animal n'a été effectué avec Beriate, de même qu'il n'y a aucunes données sur l'utilisation avec des concentrés de facteur VIII pendant la grossesse et l'allaitement du fait que l'hémophilie A est rare chez la femme. Au vu de ce qui précède, la préparation ne peut être administrée pendant la grossesse ou l'allaitement qu'en cas d'indications explicites.
Fertilité
On ne dispose d'aucune donnée concernant la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Beriate n'a aucun effet sur l'aptitude à la conduite et l'utilisation de machines.
Effets indésirables
Résumé du profil de sécurité
On a observé très rarement des réactions d'hypersensibilité ou des réactions allergiques (pouvant inclure: angio-œdème, brûlure et picotements au site d'injection, frissons, rougeur de la peau avec flush, urticaire généralisée, céphalées, exanthème, hypotension, léthargie, nausées, nervosité, tachycardie, oppression thoracique, tremblements, vomissements et stridors), ces réactions pouvant quelquefois mener à une anaphylaxie sévère (choc inclus).
Les patients souffrant de l'hémophilie A peuvent développer des anticorps neutralisants (inhibiteurs) du facteur VIII (voir chap. «Mises en garde et précautions»).. Si de tels inhibiteurs surviennent, la réaction se manifeste sous forme de réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé en hémophilie.
Les effets indésirables suivants sont basés sur l'analyse de données postmarketing ainsi que de la littérature scientifique.
La liste ci-dessous correspond à la classification MedDRA, par système et organe.
Pour la fréquence, les définitions standards suivantes ont été adoptées:
très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1000 et <1/100), rares (≥1/10'000 et <1/1000) et très rares (<1/10'000).
Description de certains effets indésirables
Affections hématologiques et du système lymphatique
Très rares: inhibiteurs du facteur VIII.
Troubles généraux et affections du site d'injection
Très rares: fièvre.
Affections du système immunitaire
Très rares: réactions d'hypersensibilité (réactions allergiques).
Pour une information sur la sécurité virale, voir également le chapitre «Mises en garde et précautions».
Enfants et adolescents
Il est attendu que la fréquence, le type et la gravité des effets secondaires chez les enfants correspondent à ceux des adultes.
Il est extrêmement important de signaler les effets secondaires suspectés après l'autorisation de mise sur le marché. Cela permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé sont priés de signaler tout effet indésirable nouveau ou grave, suspecté via le portail en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun symptôme dû à un surdosage avec des facteurs de coagulation VIII humain n'est connu à ce jour.
Propriétés/Effets
Code ATC
B02BD02
Groupe pharmaco-thérapeutique: Antihémorragique: facteur de coagulation VIII
Beriate est produit à partir de pools de plasma humain provenant de donneurs sains. L'information sur le dépistage des dons et des pools de plasma se trouve au chapitre «Mises en garde et précautions».
Le procédé de fabrication de Beriate comporte plusieurs étapes contribuant à l'élimination/l'inactivation des virus. On compte parmi celles-ci: une procédure de chromatographie, une étape de précipitation, une étape d'adsorption ainsi qu'un traitement thermique, de la préparation en solution aqueuse, pendant 10 heures à 60 °C.
Les isoagglutinines des groupes sanguins et le fibrinogène (méthode selon Clauss) sont largement éliminés par une étape de purification spécifique.
Effet
Beriate est un coagulant spécifique pour l'administration intraveineuse lors de déficience congénitale du facteur sanguin VIII.
Mécanisme d'action
Le complexe du facteur VIII/facteur de von Willebrand comprend deux sous-unités (F VIII et FvW) qui possèdent des effets physiologiques différents. Le facteur VIII adhère au facteur de von Willebrand dans la circulation sanguine des patients traités contre l'hémophilie.
Le facteur VIII activé agit comme un cofacteur du facteur IX activé, accélérant la conversion du facteur X en facteur X activé. Le facteur X activé transforme la prothrombine en thrombine. La thrombine transforme le fibrinogène en fibrine et un caillot peut alors se former. L'hémophilie A est une affection héréditaire de la coagulation sanguine liée au sexe, qui repose sur un déficit en facteur VIII:C. Suite à ce manque, des hémorragies spontanées ou accidentelles, ou même chirurgicales peuvent survenir au niveau des articulations, des muscles ou des organes internes. Le taux plasmatique en Facteur VIII est augmenté grâce au traitement substitutif, ce qui permet de corriger temporairement le déficit en Facteur VIII et les tendances hémorragiques.
Le facteur de von Willebrand, parallèlement à sa fonction de protéine stabilisant le facteur VIII, permet l'adhésion des thrombocytes sur l'endothélium vasculaire blessé et joue le rôle principal dans l'agrégation des thrombocytes.
Pharmacocinétique
Absorption et distribution
La préparation est administrée par voie intraveineuse. Après administration de 1 U.I. de facteur VIII par kg de poids corporel (taux de récupération de type incrémental), l'augmentation de l'activité du facteur VIII a été estimée à environ 2%, avec un intervalle de variation interindividus de 1,5 à 3%.
Élimination
L'activité du facteur VIII diminue sur le mode exponentiel en une ou deux phases. La demi-vie terminale varie entre 5 et 22 heures, soit une moyenne d'environ 12 heures.
La durée moyenne du temps de séjour était de 17 heures (SD 5,5 heures). L'AUC moyenne était de 0,4 h × kg/ml (SD 0,2), la clearance moyenne de 3 ml/h/kg (SD 1,5 ml/h/kg).
Enfants et adolescents
Aucune étude pharmacocinétique sur des enfants n'a été réalisée.
Données précliniques
Des études de toxicité avec des doses répétées n'ont pas été réalisées, parce que l'apport de doses répétées conduit au développement d'anticorps contre les protéines hétérologues.
Aucune toxicité n'a été démontrée lors d'expérimentations animales, même lors d'administration de doses beaucoup plus hautes que la dose humaine recommandée par kg de poids corporel. Les analyses de la préparation de facteur VIII traitée thermiquement par des anticorps polyclonaux précipitants (lapins) avec la méthode Ouchterlony et dans l'anaphylaxie cutanée passive du cobaye, ne montrent pas de différences par rapport aux réactions immunitaires comparées avec la protéine non-modifiée. Comme l'expérience clinique n'a rapporté aucun indice d'un effet carcinogène ou mutagène du facteur de coagulation VIII humain, des expérimentations animales, surtout sur les espèces hétérologues, ne sont pas jugées nécessaires.
Remarques particulières
Incompatibilités
Étant donné qu'aucune étude de compatibilité n'a été réalisée, le médicament ne peut pas être mélangé à d'autres médicaments, à l'exception du solvant indiqué au chapitre «Forme galénique et quantité de principe actif par unité».
Stabilité
Beriate ne peut être utilisé que jusqu'à la date indiquée par «EXP» sur l'emballage. Du point de vue microbiologique et parce que Beriate ne contient aucuns agents conservateurs, il est impératif d'utiliser immédiatement le produit reconstitué.
Stabilité après ouverture
La stabilité chimique et physique en cours d'utilisation du produit reconstitué a été démontrée pendant 8 heures à une température ambiante de 25 °C. D'un point de vue microbiologique, le produit doit être utilisé immédiatement. S'il n'est pas administré immédiatement, le stockage dans le flacon ne doit pas dépasser 8 heures à température ambiante. Une fois aspiré dans la seringue, le produit doit être utilisé immédiatement.
Remarques particulières concernant le stockage
Conserver le médicament hors de portée des enfants.
Conserver Beriate au réfrigérateur (2-8 °C), à l'abri de la lumière (dans l'emballage d'origine). Ne pas surgeler le produit.
Pendant la durée de conservation, Beriate peut être conservé à température ambiante (jusqu'à 25 °C) pendant une période n'excédant pas 1 mois au total.
Remarques concernant la manipulation
La solution doit être claire et légèrement opalescente. Certains flocons ou particules peuvent parfois apparaître dans le flacon. Le filtre contenu dans le set de transfert «Mix2vial™» élimine ces particules. Le calcul du dosage n'est pas influencé par cette filtration. Une fois filtré et aspiré dans la seringue jetable (voir ci-dessous), le produit reconstitue doit être inspecté visuellement à la recherche de particules et de décoloration avant d'être administré.
Ne pas utiliser les solutions troubles ou les solutions contenant un sédiment ou des particules. Une fois aspiré dans la seringue, le produit doit être utilisé immédiatement. Ne stockez pas le produit dans la seringue.
La préparation et l'administration doivent se faire sous conditions aseptiques.
Préparation:
Amener le solvant à la température ambiante. Retirer les capuchons protecteurs des flacons puis nettoyer les bouchons à l'aide d'une solution antiseptique; laisser sécher avant l'ouverture du dispositif de transfert («Mix2Vial™»).
| 1. Retirer l'opercule du dispositif de transfert «Mix2Vial». Ne pas sortir le dispositif de l'emballage sous blister |
| 2. Placer le flacon de solvant sur une surface plane, propre, et le maintenir fermement. En tenant le dispositif «Mix2Vial» verticalement à travers son emballage, enclencher l'extrémité bleue sur le bouchon du flacon de solvant. |
| 3. Retirer avec précaution l'emballage, en prenant le blister au niveau du bord de scellement et le retirer verticalement vers le haut. Bien s'assurer que seul cet emballage est retiré, et que le dispositif «Mix2Vial» reste bien en place. |
| 4. Après avoir posé le flacon de poudre sur un plan rigide, retourner l'ensemble flacon solvant- dispositif «Mix2Vial» et introduire la pointe de l'adaptateur transparent verticalement dans le bouchon du flacon de produit. Le solvant est transféré automatiquement dans le flacon de poudre. |
| 5. Dévisser le set en maintenant la partie produit reconstitué d'un côté et la partie solvant (vide) de l'autre. Jeter le flacon de solvant doté de l'adaptateur «Mix2Vial» bleu. |
| 6. Remuer doucement le flacon de produit portant l'adaptateur transparent jusqu'à ce que le produit soit complètement dissous. Ne pas secouer. |
| 7. Remplir d'air une seringue stérile, vide. Tout en maintenant le flacon du produit reconstitué verticalement, visser la seringue avec le raccord Luer du dispositif «Mix2Vial». Maintenir le piston de la seringue appuyé, retourner l'ensemble et aspirer le produit dans la seringue en tirant doucement sur le piston. |
Aspiration de la solution dans la seringue et utilisation
| 8. Maintenir le piston de la seringue appuyé, retourner l'ensemble et aspirer le produit dans la seringue en tirant doucement sur le piston. |
| 9. Lorsque la solution a été complètement transférée dans la seringue, tenir le cylindre de la seringue (en maintenant le piston dans sa position) et dévisser la seringue de l'adaptateur Mix2Vial transparent. |
Le produit non utilisé après l'injection ou le matériau usagé doit être éliminé de manière appropriée.
Numéro d’autorisation
54824 (Swissmedic)
Titulaire de l’autorisation
CSL Behring AG, Bern
Mise à jour de l’information
Mai 2020.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.


 Deutsch
Deutsch French
French Italian
Italian