KERENDIA film tablets 20 mg
KERENDIA Filmtabl 20 mg
-
12008.82 RUB
Предполагаемая дата доставки:
25.05. - 01.06.2025
При оплате криптовалютой:
Ваша прибыль 1200.88 RUB / 15.00 USDT
- Наличие: В наличии
- Модель: 7821413
- ATC-код C03DA05
- EAN 7680681300045
Варианты
КЕРЕНДИЯ пленочная таблетка 20 мг
34693.75 RUB
Описание
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie Nebenwirkungen melden. Hinweise zur Meldung von Nebenwirkungen, siehe Ende Kapitel «Welche Nebenwirkungen kann Kerendia haben?».
Was ist Kerendia und wann wird es angewendet?
Kerendia darf nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Kerendia enthält den Wirkstoff Finerenon. Finerenon ist ein nichtsteroidaler «Mineralkortikoid-Rezeptor-Antagonist» (MRA). Der Wirkstoff verhindert, dass Hormone gewisse Prozesse in Gang setzen und damit Ihre Nieren schädigen können.
Kerendia wird bei Erwachsenen mit chronischer Nierenerkrankung und Typ-2-Diabetes angewendet, um das Fortschreiten einer Nierenschädigung zu verzögern.
Eine chronische Nierenerkrankung besteht, wenn die Nieren immer schlechter in der Lage sind, Abfallstoffe und Flüssigkeit aus dem Blut zu entfernen. Typ-2-Diabetes ist eine Erkrankung, bei der Ihr Körper den Blutzuckerspiegel nicht auf normalen Werten halten kann.
Was sollte dazu beachtet werden?
Ihr Arzt bzw. Ihre Ärztin hat entschieden, dass Sie Kerendia einnehmen können und hat die korrekte Dosis für Sie bestimmt. Bei diesen Entscheidungen hat sich Ihr Arzt bzw. Ihre Ärztin auf die Ergebnisse von Bluttests gestützt. Diese Tests messen Ihren Kaliumspiegel im Blut und Ihre Nierenfunktion.
Nach 4-wöchiger Einnahme von Kerendia werden weitere Bluttests bei Ihnen durchgeführt. Ihr Arzt bzw. Ihre Ärztin entscheidet anhand der Testergebnisse, mit welcher Dosierung Sie weiterbehandelt werden sollen.
Während Ihrer Behandlung mit Kerendia kann der Arzt bzw. die Ärztin die Bluttests in bestimmten Abständen wiederholen.
Wann darf Kerendia nicht eingenommen werden?
Kerendia darf nicht eingenommen werden, wenn Sie überempfindlich gegen den Wirkstoff Finerenon oder einen der sonstigen Bestandteile von Kerendia sind.
Kerendia darf nicht eingenommen werden, wenn Sie andere Arzneimittel einnehmen, die zur Gruppe der sogenannten «starken CYP3A4-Hemmer» gehören, wie zum Beispiel:
- Itraconazol oder Ketoconazol zur Behandlung von Pilzinfektionen
- Ritonavir, Nelfinavir oder Cobicistat zur Behandlung einer HIV-Infektion
- Clarithromycin oder Telithromycin zur Behandlung bakterieller Infektionen
- Nefazodon zur Behandlung von Depressionen
Kerendia darf nicht eingenommen werden, wenn Sie an der Addison-Krankheit leiden, bei der Ihr Körper die Hormone Cortisol und Aldosteron nicht in ausreichender Menge produziert.
Wann ist bei der Einnahme von Kerendia Vorsicht geboten?
Bitte sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, bevor Sie Kerendia einnehmen, wenn Sie
- einen erhöhten Kaliumspiegel im Blut haben oder in der Vergangenheit hatten,
- eine schwere Nierenfunktionsstörung oder Nierenversagen haben,
- mässige oder schwere Leberschädigung haben.
Sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin, wenn Sie Arzneimittel einnehmen, die Ihre Behandlung mit Kerendia beeinflussen können. Wenn Sie während der Behandlung mit Kerendia andere Arzneimittel der Gruppe «mässige oder schwache CYP3A4-Hemmer» einnehmen, können bei Ihnen mehr Nebenwirkungen auftreten, da diese die Finerenon-Konzentration in Ihrem Blut erhöhen können (siehe «Welche Nebenwirkungen kann Kerendia haben?»). Dies könnte beispielsweise bei der Einnahme folgender Arzneimittel zutreffen:
- Erythromycin (zur Behandlung bakterieller Infektionen)
- Verapamil (zur Behandlung von Bluthochdruck, Schmerzen im Brustkorb und schnellem Herzschlag)
- Amiodaron (zur Behandlung von Herzrhythmusstörungen)
- Fluvoxamin (zur Behandlung von Depressionen und Zwangsstörungen)
Kerendia wirkt möglicherweise nicht wie erwartet, wenn Sie während der Behandlung mit Kerendia andere Arzneimittel einnehmen, die zur Gruppe der «starken oder mässigen CYP3A4-Verstärker» gehören, da diese die Finerenon-Konzentration in Ihrem Blut erniedrigen können. Dies könnte beispielsweise bei der Einnahme folgender Arzneimittel zutreffen:
- Rifampicin (zur Behandlung bakterieller Infektionen)
- Carbamazepin, Phenytoin oder Phenobarbital (zur Behandlung von Epilepsie)
- Johanniskraut (ein pflanzliches Arzneimittel zur Behandlung von Depressionen)
- Efavirenz (zur Behandlung der HIV-Infektion)
Es kann gefährlich für Sie sein, wenn Sie während der Behandlung mit Kerendia andere Arzneimittel einnehmen, die den Kaliumspiegel in Ihrem Blut erhöhen können. Der Kaliumspiegel in Ihrem Blut kann zu hoch sein, wenn Sie zum Beispiel eines dieser Arzneimittel einnehmen:
- Amilorid oder Triamteren („Entwässerungstabletten“, die übermässiges Wasser aus Ihrem Körper über den Urin ausscheiden)
- ähnliche Mineralkortikoid-Rezeptor-Antagonisten wie Finerenon, wie zum Beispiel Eplerenon, Esaxerenon, Spironolacton oder Canrenon (zur Regulierung des Blutdrucks und der Herzfunktion)
- Trimethoprim oder eine Kombination von Trimethoprim und Sulfamethoxazol (zur Behandlung bakterieller Infektionen)
- Kaliumergänzungspräparate
Essen Sie keine Grapefruits und trinken Sie keinen Grapefruitsaft während Sie Kerendia einnehmen.
Wenn Sie dies tun, kann sich die Konzentration von Finerenon in Ihrem Blut erhöhen. In der Folge können mehr Nebenwirkungen bei Ihnen auftreten (siehe «Welche Nebenwirkungen kann Kerendia haben?»).
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist also nahezu «natriumfrei».
Fragen Sie bei Ihrem Arzt bzw. Ihrer Ärztin nach, bevor Sie Kerendia zusammen mit einem Salzersatzstoff einnehmen. Einige Salzersatzstoffe enthalten Kalium. Wenn Sie diese während der Behandlung mit Kerendia verwenden, kann die Konzentration von Kalium in Ihrem Blut zu hoch werden. Dies kann gefährlich für Sie sein.
Bitte nehmen Sie Kerendia erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Milchzuckerunverträglichkeit (Laktoseintoleranz) leiden.
Basierend auf dem Sicherheitsprofil von Kerendia wird kein Einfluss auf die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, erwartet.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen!
Darf Kerendia während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin um Rat.
Sie dürfen dieses Arzneimittel nicht während der Schwangerschaft einnehmen, es sei denn, Ihr Arzt bzw. Ihre Ärztin hält es für zwingend notwendig. Es besteht möglicherweise ein Risiko für Ihr ungeborenes Kind. Ihr Arzt bzw. Ihre Ärztin bespricht dies mit Ihnen.
Sie sollten eine zuverlässige Methode der Empfängnisverhütung während der gesamten Behandlungsdauer anwenden, wenn Sie schwanger werden könnten. Ihr Arzt bzw. Ihre Ärztin erklärt Ihnen, welche Form von Empfängnisverhütung Sie verwenden können.
Während der Behandlung mit Kerendia sollten Sie nicht stillen, da dies Ihrem Kind schaden kann. Falls der Arzt bzw. die Ärztin Kerendia ausdrücklich verordnet hat, sollte vorher abgestillt werden.
Wie verwenden Sie Kerendia?
Nehmen Sie Kerendia immer genau nach Absprache mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin ein. Kerendia wird zusätzlich zu anderen Medikamenten zur Behandlung Ihrer Erkrankung eingenommen. Fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin nach, wenn Sie sich nicht sicher sind.
Wie viel Kerendia Sie einnehmen müssen
Nehmen Sie einmal täglich 1 Tablette ein. Jede Tablette enthält 10 mg oder 20 mg Finerenon. Ihr Arzt bzw. Ihre Ärztin verordnet Ihnen 10 mg oder 20 mg einmal täglich, je nach den Ergebnissen Ihrer Bluttests.
Ihr Arzt bzw. Ihre Ärztin kann Ihre Behandlung jederzeit entsprechend der Ergebnisse Ihrer Bluttests anpassen. Weitere Informationen finden Sie unter «Was sollte dazu beachtet werden?».
Wie Kerendia einzunehmen ist
Nehmen Sie Kerendia jeden Tag zur gleichen Zeit ein. Das macht es leichter für Sie, die Einnahme nicht zu vergessen.
Schlucken Sie die Tablette unzerkaut. Sie können die Tablette mit einem Glas Wasser einnehmen. Sie können die Tablette zu den Mahlzeiten oder unabhängig davon einnehmen. Nehmen Sie Kerendia nicht zusammen mit Grapefruitsaft oder Grapefruits ein.
Falls Sie die Tablette nicht im Ganzen schlucken können, können Sie sie zerstossen. Vermischen Sie die zerstossene Tablette mit Wasser oder weichen Nahrungsmitteln, wie zum Beispiel Apfelmus, und nehmen Sie sie sofort ein.
Wenn Sie eine grössere Menge von Kerendia eingenommen haben, als Sie sollten
Sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin, wenn Sie glauben, dass Sie zu viel von diesem Arzneimittel eingenommen haben.
Wenn Sie die Einnahme von Kerendia vergessen haben
Wenn Sie vergessen, Ihre Tablette zur vorgesehenen Tageszeit einzunehmen:
Nehmen Sie die Tablette noch am gleichen Tag ein, sobald Sie bemerken, dass Sie die Einnahme vergessen haben.
Wenn Sie einen Tag versäumen:
Nehmen Sie die nächste Tablette am nächsten Tag ein.
Nehmen Sie nicht die doppelte Menge ein, wenn Sie die vorherige Einnahme vergessen haben.
Wenn Sie die Einnahme von Kerendia abbrechen
Beenden Sie die Einnahme von Kerendia nur nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin.
Ihr Arzt bzw. Ihre Ärztin kann die Entscheidung zur Beendigung der Einnahme treffen, nachdem Bluttests bei Ihnen durchgeführt wurden.
Die Anwendung und Sicherheit von Kerendia bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht geprüft worden.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Kerendia haben?
Wie alle Arzneimittel kann auch Kerendia Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Im Folgenden sind die Nebenwirkungen von Kerendia nach Häufigkeit angegeben.
Sehr häufig (betrifft mehr als einen von 10 Anwendern)
Hoher Kaliumspiegel (Hyperkaliämie)
Häufig (betrifft 1 bis 10 von 100 Anwendern)
Niedriger Natriumspiegel (Hyponatriämie), Niedriger Blutdruck (Hypotonie), Verminderte Fähigkeit der Nieren, das Blut zu filtern (erniedrigte glomeruläre Filtrationsrate)
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
In der Originalverpackung aufbewahren.
Weitere Hinweise
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Kerendia enthalten?
Wirkstoffe
Eine Filmtablette Kerendia enthält 10 mg oder 20 mg Finerenon.
Hilfsstoffe
Mikrokristalline Zellulose, Croscarmellose-Natrium, Lactose-Monohydrat, Magnesiumstearat, Hypromellose, Natriumdodecylsulfat.
Filmüberzug: Hypromellose, Talkum, Titandioxid (E 171), Eisenoxid rot (E 172) (nur in der 10 mg Dosisstärke enthalten), Eisenoxid gelb (E 172) (nur in der 20 mg Dosisstärke enthalten).
Aussehen
10 mg: rosa, ovale Filmtablette mit einer Länge von 10 mm und einer Breite von 5 mm, mit der Prägung «10» auf einer Seite und «FI» auf der anderen Seite.
20 mg: gelbe, ovale Filmtablette mit einer Länge von 10 mm und einer Breite von 5 mm, mit der Prägung «20» auf einer Seite und «FI» auf der anderen Seite.
Zulassungsnummer
68130 (Swissmedic).
Wo erhalten Sie Kerendia? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Kerendia 10 mg gibt es in Packungen zu 28 und 98 Filmtabletten.
Kerendia 20 mg gibt es in Packungen zu 28 und 98 Filmtabletten.
Zulassungsinhaberin
Bayer (Schweiz) AG, Zürich.
Diese Packungsbeilage wurde im August 2021 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
▼ Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet secondaire. Voir à la fin de la rubrique «Quels effets secondaires Kerendia peut-il provoquer?» pour savoir comment déclarer les effets secondaires.
Qu'est-ce que Kerendia et quand doit-il être utilisé?
Kerendia doit être utilisé uniquement selon la prescription du médecin.
Kerendia contient le principe actif finérénone. La finérénone est un «antagoniste non stéroïdien des récepteurs des minéralocorticoïdes» (ARM). Le principe actif empêche que des hormones déclenchent certains processus pouvant provoquer des lésions rénales.
Kerendia est utilisé chez les adultes atteints de néphropathie chronique et de diabète de type 2 pour retarder la progression de l'atteinte rénale.
Une néphropathie chronique se traduit par la diminution progressive de la capacité des reins à éliminer du sang les déchets et l'eau en excès. Le diabète de type 2 est une maladie se caractérisant par l'impossibilité de votre organisme à maintenir le taux de sucre dans le sang (glycémie) à des valeurs normales.
De quoi faut-il tenir compte en dehors du traitement?
Votre médecin a décidé que vous pouvez prendre Kerendia et a déterminé la dose adéquate qui vous convient. Cette décision repose sur les résultats des analyses de sang qui mesurent votre taux de potassium dans le sang et évaluent votre fonction rénale.
Après la prise de Kerendia pendant 4 semaines, des analyses de sang complémentaires seront effectuées. Votre médecin décidera sur la base des résultats des analyses à quelle posologie vous devez continuer le traitement.
Au cours du traitement par Kerendia, le médecin effectuera à nouveau des analyses de sang à intervalles déterminés.
Quand Kerendia ne doit-il pas être pris?
Kerendia ne doit pas être pris si vous êtes hypersensible à la finérénone ou à l'un des autres composants de Kerendia.
Kerendia ne doit pas être pris si vous prenez d'autres médicaments qui font partie du groupe de médicaments appelés «inhibiteurs puissants du CYP3A4», tels que:
- l'itraconazole ou le kétoconazole utilisés pour le traitement des infections fongiques
- le ritonavir, le nelfinavir ou le cobicistat utilisés pour le traitement d'une infection au VIH
- la clarithromycine ou la télithromycine utilisées pour le traitement d'infections bactériennes
- la néfazodone utilisée pour le traitement des dépressions
Kerendia ne doit pas être pris si vous souffrez de la maladie d'Addison se caractérisant par une production en quantité insuffisante des hormones cortisol et aldostérone.
Quelles sont les précautions à observer lors de la prise de Kerendia?
Veuillez vous adresser à votre médecin avant de prendre Kerendia si:
- vous avez ou avez eu par le passé un taux élevé de potassium dans le sang
- vous avez un trouble sévère de la fonction rénale ou une insuffisance rénale
- vous avez une lésion hépatique modérée ou sévère
Consultez votre médecin ou votre pharmacien si vous prenez des médicaments pouvant affecter votre traitement par Kerendia. Si vous prenez d'autres médicaments qui font partie du groupe des «inhibiteurs faibles ou modérés du CYP3A4» pendant le traitement par Kerendia, vous êtes susceptible de présenter davantage d'effets secondaires, car ces médicaments peuvent augmenter la concentration de finérénone dans le sang (voir «Quels effets secondaires Kerendia peut-il provoquer?»). Ceci pourrait se produire par exemple en cas de prise des médicaments suivants:
- érythromycine (utilisée pour le traitement d'infections bactériennes)
- vérapamil (utilisé pour le traitement de l'hypertension artérielle, des douleurs dans la cage thoracique et des battements cardiaques rapides)
- amiodarone (utilisée pour le traitement des troubles du rythme cardiaque)
- fluvoxamine (utilisée pour le traitement des dépressions et des troubles obsessionnels compulsifs)
Kerendia peut ne pas agir comme escompté si vous prenez d'autres médicaments qui font partie du groupe des «inducteurs puissants ou modérés du CYP3A4» pendant le traitement par Kerendia, car ces médicaments peuvent abaisser la concentration de finérénone dans le sang. Ceci pourrait se produire par exemple en cas de prise des médicaments suivants:
- rifampicine (utilisée pour le traitement d'infections bactériennes)
- carbamazépine, phénytoïne ou phénobarbital (utilisés pour le traitement de l'épilepsie)
- millepertuis (médicament phytothérapeutique utilisé pour le traitement des dépressions)
- éfavirenz (utilisé pour le traitement de l'infection au VIH)
La prise d'autres médicaments susceptibles d'augmenter le taux de potassium dans le sang pendant le traitement par Kerendia peut être dangereuse. Le taux de potassium dans le sang peut être trop élevé si vous prenez par exemple l'un des médicaments suivants:
- amiloride ou triamtérène («comprimés diurétiques» qui éliminent l'excès d'eau dans l'organisme avec l'urine)
- antagonistes des récepteurs des minéralocorticoïdes similaires à la finérénone tels que, l'éplérénone, l'ésaxérénone, la spironolactone ou la canrénone (utilisés pour réguler la pression artérielle et la fonction cardiaque)
- triméthoprime ou association de triméthoprime et de sulfaméthoxazole (utilisés pour le traitement d'infections bactériennes)
- suppléments potassiques
Ne consommez pas de pamplemousse ni de jus de pamplemousse pendant le traitement par Kerendia car la concentration de finérénone dans le sang pourrait augmenter. En conséquence, vous êtes susceptible de présenter davantage d'effets secondaires (voir «Quels effets secondaires Kerendia peut-il provoquer?»).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
Consultez votre médecin avant de prendre Kerendia en même temps qu'un substitut du sel. Certains substituts du sel contiennent du potassium. Si vous utilisez ceux-ci pendant le traitement par Kerendia, la concentration de potassium dans le sang peut être trop élevée, ce qui pourrait être dangereux.
Si votre médecin vous a informé(e) d'une intolérance à certains sucres (intolérance au lactose), contactez-le avant de prendre ce médicament.
Sur la base du profil de sécurité de Kerendia, une influence sur l'aptitude à conduire et la capacité à utiliser des outils ou des machines n'est pas attendue.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments (même en automédication!).
Kerendia peut-il être pris pendant la grossesse ou l'allaitement?
Si vous êtes enceinte ou si vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Vous ne devez pas prendre ce médicament pendant la grossesse sauf si votre médecin estime que ce traitement est absolument nécessaire. Il existe un risque potentiel pour l'enfant à naître. Votre médecin en parlera avec vous.
Vous devez utiliser une méthode fiable de contraception pendant toute la durée du traitement si vous pourriez être enceinte. Votre médecin vous expliquera quel type de contraception vous pouvez utiliser.
Vous ne devez pas allaiter pendant le traitement par Kerendia, car ceci peut nuire à votre enfant. Arrêtez l'allaitement en cas de prescription formelle de Kerendia par le médecin.
Comment utiliser Kerendia?
Veillez à toujours prendre Kerendia en suivant exactement les indications de votre médecin ou de votre pharmacien. Kerendia sera pris en complément d'autres médicaments pour traiter votre maladie. Vérifiez auprès de votre médecin ou votre pharmacien en cas de doute.
Quelle quantité de Kerendia prendre?
Prenez 1 comprimé une fois par jour. Un comprimé contient 10 mg ou 20 mg de finérénone. Votre médecin vous prescrira 10 mg ou 20 mg une fois par jour selon les résultats de vos analyses de sang.
Votre médecin peut ajuster votre traitement à tout moment en fonction des résultats de vos analyses de sang. Vous trouverez de plus amples informations à la rubrique «De quoi faut-il tenir compte en dehors du traitement?».
Comment prendre Kerendia?
Prenez Kerendia tous les jours au même moment de la journée pour vous faciliter la prise du médicament et éviter d'oublier de le prendre.
Avalez le comprimé sans le croquer. Vous pouvez prendre le comprimé avec un verre d'eau. Vous pouvez prendre le comprimé pendant ou indépendamment des repas. Ne consommez pas de jus de pamplemousse ni de pamplemousses pendant le traitement par Kerendia.
Si vous n'êtes pas en mesure d'avaler les comprimés entiers, vous pouvez les écraser. Mélangez le comprimé écrasé avec de l'eau ou des aliments mous, tels que de la compote de pommes, et prenez-le immédiatement.
Si vous avez pris plus de Kerendia que vous n'auriez dû
Consultez votre médecin ou votre pharmacien si vous pensez que vous avez pris une quantité trop importante de ce médicament.
Si vous oubliez de prendre Kerendia
Si vous oubliez de prendre votre comprimé au moment de la journée prévu:
prenez le comprimé le même jour dès que vous vous apercevez que vous avez oublié de le prendre.
En cas d'omission d'une prise:
prenez le comprimé suivant le lendemain.
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous arrêtez de prendre Kerendia
N'arrêtez pas de prendre Kerendia sans avoir consulté au préalable votre médecin.
Votre médecin peut décider d'arrêter la prise du médicament après avoir effectué des analyses de sang.
L'utilisation et la sécurité de Kerendia n'ont pas été établies à ce jour pour les enfants et les adolescents de moins de 18 ans.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Kerendia peut-il provoquer?
Comme tous les médicaments, Kerendia peut provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets secondaires de Kerendia sont indiqués ci-dessous par fréquence.
Très fréquent (concerne plus d'une personne sur 10)
Taux élevé de potassium (hyperkaliémie)
Fréquent (concerne 1 à 10 personnes sur 100)
Faible taux de sodium (hyponatrémie), pression artérielle faible (hypotension), diminution de la capacité des reins à filtrer le sang (taux de filtration glomérulaire diminué)
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention <EXP> sur le récipient.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30°C.
Conserver hors de portée des enfants.
Conserver dans l'emballage d'origine.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Kerendia?
Principes actifs
Un comprimé pelliculé de Kerendia contient 10 mg ou 20 mg de finérénone.
Excipients
Cellulose microcristalline, croscarmellose sodique, lactose monohydraté, stéarate de magnésium, hypromellose, laurylsulfate de sodium.
Pelliculage: hypromellose, talc, dioxyde de titane (E 171), oxyde de fer rouge (E 172) (uniquement pour les comprimés dosés à 10 mg), oxyde de fer jaune (E 172) (uniquement pour les comprimés dosés à 20 mg).
Aspect
10 mg: comprimé pelliculé de couleur rose, de forme ovale, d'une longueur de 10 mm et d'une largeur de 5 mm avec l'inscription «10» sur une face et «FI» sur l'autre face.
20 mg: comprimé pelliculé de couleur jaune, de forme ovale, d'une longueur de 10 mm et d'une largeur de 5 mm avec l'inscription «20» sur une face et «FI» sur l'autre face.
Numéro d'autorisation
68130 (Swissmedic).
Où obtenez-vous Kerendia? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Kerendia 10 mg est disponible en emballages de 28 et 98 comprimés pelliculés.
Kerendia 20 mg est disponible en emballages de 28 et 98 comprimés pelliculés.
Titulaire de l'autorisation
Bayer (Schweiz) AG, Zurich.
Cette notice d'emballage a été vérifiée pour la dernière fois en août 2021 par l'autorité de contrôle des médicaments (Swissmedic).
▼ Questo medicamento è soggetto a monitoraggio addizionale. Ciò consente una rapida identificazione delle nuove conoscenze in materia di sicurezza. Può contribuire segnalandone gli effetti collaterali. Per istruzioni sulle modalità di notifica degli effetti collaterali si veda al termine del capitolo «Quali effetti collaterali può avere Kerendia?».
Che cos'è Kerendia e quando si usa?
Kerendia può essere usato solo su prescrizione medica.
Kerendia contiene il principio attivo finerenone. Il finerenone è un «antagonista non steroideo del recettore dei mineralcorticoidi» (MRA). Il principio attivo impedisce che gli ormoni possano avviare certi processi e pertanto danneggiare i reni del paziente.
Kerendia si usa negli adulti con malattia renale cronica e diabete di tipo 2 per ritardare la progressione del danno renale.
La malattia renale cronica deteriora progressivamente i reni che non riescono più a eliminare prodotti di scarto e liquidi dal sangue. Il diabete di tipo 2 è una malattia che impedisce all'organismo di mantenere lo zucchero nel sangue a livelli normali.
Di che cosa occorre inoltre tener conto durante il trattamento?
Il suo medico ha deciso che lei può assumere Kerendia e ha determinato la dose corretta nel suo caso. Per prendere queste decisioni, il suo medico si è basato sui risultati degli esami del sangue. Questi esami misurano il livello di potassio nel suo sangue e la sua funzionalità renale.
Dopo che avrà assunto Kerendia per 4 settimane, saranno effettuati nuovi esami del sangue. A fronte dei risultati di questi esami, il suo medico deciderà a quale posologia lei debba proseguire il trattamento.
Durante il trattamento con Kerendia, il medico potrà ripetere gli esami del sangue a determinati intervalli.
Quando non si può assumere Kerendia?
Kerendia non deve essere assunto in caso di ipersensibilità al principio attivo finerenone o a uno degli altri componenti.
Kerendia non deve essere assunto in caso di assunzione di altri medicamenti appartenenti al gruppo dei cosiddetti «inibitori potenti del CYP3A4», come ad esempio:
- itraconazolo o ketonazolo per il trattamento delle infezioni fungine
- ritonavir, nelfinavir o cobicistat per il trattamento di un'infezione da HIV
- claritromicina o telitromicina per il trattamento delle infezioni batteriche
- nefazodone per il trattamento della depressione
Non deve assumere Kerendia se soffre di malattia di Addison, che causa un'insufficiente produzione degli ormoni cortisolo e aldosterone da parte dell'organismo.
Quando è richiesta prudenza nella somministrazione di Kerendia?
Parli con il suo medico prima di assumere Kerendia se:
- ha, o ha avuto in passato, livelli elevati di potassio nel sangue,
- ha un grave disturbo della funzionalità renale o soffre di insufficienza renale,
- ha un danno al fegato di grado moderato o severo.
Parli con il suo medico o il suo farmacista se assume medicamenti che possono influire sul trattamento con Kerendia. Se durante il trattamento con Kerendia assume altri medicamenti appartenenti al gruppo degli «inibitori deboli o moderati del CYP3A4», possono manifestarsi più effetti collaterali poiché questi medicamenti possono aumentare la concentrazione di finerenone nel sangue (cfr. «Quali effetti collaterali può avere Kerendia?»). Ciò potrebbe verificarsi, ad esempio, con l'assunzione dei seguenti medicamenti:
- eritromicina (per il trattamento delle infezioni batteriche)
- verapamil (per il trattamento dell'ipertensione, del dolore toracico e del battito cardiaco accelerato)
- amiodarone (per il trattamento dei disturbi del ritmo cardiaco)
- fluvoxamina (per il trattamento della depressione e del disturbo ossessivo-compulsivo)
Kerendia potrebbe non fare effetto come previsto se durante il trattamento assume in concomitanza altri medicamenti appartenenti al gruppo degli «induttori potenti o moderati del CYP3A4» poiché questi possono abbassare la concentrazione di finerenone nel sangue. Ciò potrebbe verificarsi, ad esempio, con l'assunzione dei seguenti medicamenti:
- rifampicina (per il trattamento delle infezioni batteriche)
- carbamazepina, fenitoina o fenobarbital (per il trattamento dell'epilessia)
- erba di San Giovanni (un medicamento fitoterapeutico per il trattamento della depressione)
- efavirenz (per il trattamento dell'infezione da HIV)
L'assunzione durante il trattamento con Kerendia di altri medicamenti che possono aumentare il livello di potassio nel sangue può essere pericoloso. Il livello di potassio nel sangue può essere troppo elevato, ad esempio, se assume uno di questi medicamenti:
- amiloride o triamterene (diuretici per eliminare dall'organismo l'acqua in eccesso attraverso l'urina)
- antagonisti del recettore dei mineralcorticoidi simili a finerenone, come ad esempio eplerenone, esaxerenone, spironolattone o canrenone (per regolare la pressione sanguigna e la funzionalità cardiaca)
- trimetoprim o una combinazione di trimetoprim e sulfametossazolo (per il trattamento delle infezioni batteriche)
- integratori di potassio
Non mangi pompelmo né beva succo di pompelmo durante l'assunzione di Kerendia perché il pompelmo può aumentare la concentrazione di finerenone nel suo sangue. Di conseguenza possono manifestarsi più effetti collaterali (cfr. «Quali effetti collaterali può avere Kerendia?»).
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa, cioè essenzialmente «senza sodio».
Consulti il suo medico prima di assumere Kerendia con un sostituto del sale. Alcuni sostituti del sale contengono potassio. L'uso di questi prodotti durante il trattamento con Kerendia può aumentare eccessivamente la concentrazione di potassio nel sangue. Ciò può essere pericoloso per lei.
Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri (intolleranza al lattosio), lo contatti prima di prendere questo medicamento.
Sulla base del profilo di sicurezza di Kerendia non si prevedono effetti sulla capacità di condurre un veicolo e sulla capacità di utilizzare attrezzi o macchine.
Informi il suo medico o il suo farmacista, nel caso in cui
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa)!
Si può assumere Kerendia durante la gravidanza o l'allattamento?
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o durante l'allattamento, chieda consiglio al suo medico o al suo farmacista prima di assumere questo medicamento.
Non deve usare questo medicamento durante la gravidanza, a meno che il medico non lo ritenga assolutamente necessario. Potrebbe sussistere un rischio per il feto. Il suo medico ne parlerà con lei.
Se è in età fertile, deve usare un metodo contraccettivo affidabile per l'intera durata del trattamento. Il suo medico le spiegherà quale forma di contraccezione può usare.
Durante il trattamento con Kerendia non deve allattare poiché ciò può nuocere al bambino. Se il medico le ha espressamente prescritto Kerendia, deve interrompere l'allattamento prima di iniziare ad assumerlo.
Come usare Kerendia?
Assuma Kerendia sempre esattamente come concordato con il suo medico o il suo farmacista. Kerendia si assume in aggiunta ad altri medicamenti per il trattamento della sua malattia. Se ha dubbi consulti il suo medico o farmacista.
Quanto Kerendia assumere
Assuma 1 compressa una volta al giorno. Ogni compressa contiene 10 mg o 20 mg di finerenone. Il suo medico le prescriverà 10 mg o 20 mg una volta al giorno, in base ai risultati dei suoi esami del sangue.
Il suo medico potrà adeguare il suo trattamento in qualsiasi momento in base ai risultati di questi esami. Per ulteriori informazioni cfr. «Di che cosa occorre inoltre tener conto durante il trattamento?».
Come assumere Kerendia
Assuma Kerendia ogni giorno alla stessa ora. In questo modo le sarà più facile non dimenticarsene.
La compressa deve essere deglutita intera. Può assumerla con un bicchiere d'acqua, ai pasti o indipendentemente dai pasti. Non assuma Kerendia con succo o polpa di pompelmo.
Se non riesce a deglutire la compressa intera, può frantumarla. Mescoli la compressa frantumata con acqua o con cibi morbidi, ad esempio purea di mela, e assuma il tutto subito.
Se ha assunto più Kerendia di quanto avrebbe dovuto
Parli con il suo medico o il suo farmacista se crede di aver assunto una quantità eccessiva di questo medicamento.
Se dimentica di assumere Kerendia
Se dimentica di assumere la compressa all'orario previsto:
prenda la compressa ancora nello stesso giorno, non appena si accorge della dimenticanza.
Se salta un giorno:
assuma la compressa successiva il giorno dopo.
Non assuma una dose doppia se ha dimenticato l'assunzione precedente.
Se interrompe l'assunzione di Kerendia
Non interrompa l'assunzione di Kerendia senza prima consultare il suo medico.
Il medico potrà decidere di farle interrompere l'assunzione dopo averla sottoposta ad esami del sangue.
L'uso e la sicurezza di Kerendia nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Kerendia?
Come tutti i medicamenti, anche Kerendia può avere effetti collaterali sebbene non tutte le persone li manifestino.
Di seguito sono indicati gli effetti collaterali di Kerendia in base alla loro frequenza.
Molto comune (riguarda più di 1 persona su 10)
Alto livello di potassio (iperkaliemia)
Comune (riguarda da 1 a 10 persone su 100)
Basso livello di sodio (iponatriemia), bassa pressione sanguigna (ipotensione), ridotta capacità dei reni di filtrare il sangue (velocità di filtrazione glomerulare ridotta)
Se osserva effetti collaterali, si rivolga al suo medico o al suo farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Istruzioni di conservazione
Non conservare a temperature superiori a 30°C.
Tenere fuori dalla portata dei bambini.
Conservare nella confezione originale.
Ulteriori indicazioni
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Kerendia?
Principi attivi
Una compressa rivestita con film di Kerendia contiene 10 mg o 20 mg di finerenone.
Sostanze ausiliarie
Cellulosa microcristallina, croscarmellosa sodica, lattosio monoidrato, magnesio stearato, ipromellosa, sodio laurilsolfato.
Film di rivestimento: Ipromellosa, talco, biossido di titanio (E 171), ossido di ferro rosso (E 172) (contenuto solo nel dosaggio da 10 mg), ossido di ferro giallo (E 172) (contenuto solo nel dosaggio da 20 mg).
Aspetto
10 mg: compressa rivestita con film ovale, rosa, lunga 10 mm e larga 5 mm, con impresso «10» su un lato e «FI» sull'altro lato.
20 mg: compressa rivestita con film ovale, gialla, lunga 10 mm e larga 5 mm, con impresso «20» su un lato e «FI» sull'altro lato.
Numero dell'omologazione
68130 (Swissmedic).
Dove è ottenibile Kerendia? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Kerendia 10 mg è disponibile in confezioni da 28 e 98 compresse rivestite con film.
Kerendia 20 mg è disponibile in confezioni da 28 e 98 compresse rivestite con film.
Titolare dell'omologazione
Bayer (Schweiz) AG, Zurigo.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'agosto 2021 dall'autorità competente in materia di medicamenti (Swissmedic).
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, den Verdacht einer neuen oder schwerwiegenden Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Rubrik «Unerwünschte Wirkungen».
Zusammensetzung
Wirkstoffe
Finerenonum.
Hilfsstoffe
Cellulosum microcristallinum, Carmellosum natricum conexum, Lactosum monohydricum, Magnesii stearas, Hypromellosum, Natrii laurilsulfas.
Filmüberzug: Hypromellosum, Talcum, Titanii dioxidum (E 171), Ferrum oxydatum rubrum (E 172) (nur in der 10 mg Dosisstärke enthalten), Ferrum oxydatum flavum (E 172) (nur in der 20 mg Dosisstärke enthalten).
Eine 10 mg Filmtablette enthält 0.44 mg Natrium und 42.75 mg Lactose.
Eine 20 mg Filmtablette enthält 0.47 mg Natrium und 38.00 mg Lactose.
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtabletten à 10 mg und 20 mg Finerenon.
Aussehen
10 mg: rosa, ovale Filmtablette mit einer Länge von 10 mm und einer Breite von 5 mm, mit der Prägung «10» auf einer Seite und «FI» auf der anderen Seite.
20 mg: gelbe, ovale Filmtablette mit einer Länge von 10 mm und einer Breite von 5 mm, mit der Prägung «20» auf einer Seite und «FI» auf der anderen Seite.
Indikationen/Anwendungsmöglichkeiten
Kerendia ist indiziert zur Verzögerung der Progression einer chronischen Nierenerkrankung bei erwachsenen Patienten mit Typ-2-Diabetes mellitus (siehe Rubriken «Dosierung/Anwendung» und «Klinische Wirksamkeit»).
Für Studienergebnisse zu Auswirkungen auf kardiovaskuläre Ereignisse siehe Rubrik «Klinische Wirksamkeit».
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Zieldosis von Kerendia beträgt 20 mg einmal täglich (entspricht der maximalen Tagesdosis).
Therapieeinleitung
Kerendia sollte in Ergänzung zur Standardtherapie angewandt werden (siehe Rubrik «Klinische Wirksamkeit»).
Eine Therapieeinleitung mit Kerendia wird empfohlen, wenn der Serumkaliumspiegel ≤4.8 mmol/l beträgt. Zur Überwachung des Serumkaliums siehe «Erhaltungstherapie».
Wenn der Serumkaliumspiegel > 4.8 bis 5.0 mmol/l beträgt, kann je nach Patientenmerkmalen und Serumkaliumspiegel eine Behandlung mit Kerendia in Betracht gezogen werden, wobei in den ersten 4 Wochen eine zusätzliche Überwachung des Serumkaliums erfolgen sollte (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Wenn der Serumkaliumspiegel > 5.0 mmol/l beträgt, wird eine Behandlung mit Kerendia nicht empfohlen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Zur Bestimmung der Anfangsdosis wird die geschätzte glomeruläre Filtrationsrate (eGFR) gemessen. Die Anfangsdosis von Kerendia beträgt:
- 20 mg einmal täglich, wenn eGFR ≥60 ml/min/1.73 m2
- 10 mg einmal täglich, wenn eGFR ≥25 bis < 60 ml/min/1.73 m2
Eine Therapieeinleitung mit Kerendia wird bei Patienten mit eGFR < 25 ml/min/1.73 m2 aufgrund der begrenzten klinischen Erfahrungen nicht empfohlen.
Erhaltungstherapie
Vier Wochen nach Einleitung, Wiederbeginn oder Auftitration der Behandlung mit Kerendia müssen Serumkalium und eGFR erneut gemessen werden. Um die Fortsetzung der Behandlung mit Kerendia und die Dosisanpassung zu bestimmen, siehe Tabelle 1. Danach soll die Messung des Serumkaliums periodisch und bei Bedarf auf der Grundlage der Patientenmerkmale und des Serumkaliumspiegels wiederholt werden (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Tabelle 1: Fortsetzung (4 Wochen nach Einleitung, Wiederbeginn oder Auftitration) der Behandlung mit Kerendia und Dosisanpassung
Serumkalium (mmol/l) | Dosierung von Kerendia (ab Woche 5) |
≤4.8 | Dosierung von 20 mg einmal täglich beibehalten. Bei Patienten mit einer Dosierung von 10 mg einmal täglich die Dosierung auf 20 mg einmal täglich steigern, wenn eGFR nicht um > 30 % gegenüber der vorherigen Messung abgenommen hat. |
> 4.8–5.5 | Dosierung beibehalten. |
> 5.5 | Gabe von Kerendia aussetzen. Gabe mit 10 mg einmal täglich wieder aufnehmen, wenn Serumkalium ≤5.0 mmol/l. |
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) ist eine Behandlung mit Kerendia zu vermeiden (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Bei Patienten mit leichter bis mittelschwerer Leberinsuffizienz ist keine initiale Dosisanpassung erforderlich (Child-Pugh A oder B) (siehe Rubrik «Pharmakokinetik»).
Bei Patienten mit mittelschwerer Leberinsuffizienz (Child-Pugh B) ist eine zusätzliche Überwachung des Serumkaliums in Betracht zu ziehen und die Überwachung je nach Patientenmerkmalen anzupassen (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Therapieeinleitung
Bei Patienten mit eGFR ≥25 bis < 60 ml/min/1.73 m2 beträgt die Anfangsdosis von Kerendia 10 mg einmal täglich.
Bei Patienten mit eGFR < 25 ml/min/1.73 m2 wird eine Therapieeinleitung mit Kerendia aufgrund der begrenzten klinischen Erfahrungen nicht empfohlen (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Erhaltungstherapie
Bei Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung erfolgt die Weiterbehandlung mit Kerendia und die Dosisanpassung in Abhängigkeit vom Serumkalium.
Um zu bestimmen, ob die Anfangsdosis auf die empfohlene Tagesdosis erhöht werden kann, ist die eGFR 4 Wochen nach Einleitung der Behandlung zu bestimmen. Siehe Tabelle 1 und «Erhaltungstherapie».
Bei Patienten mit terminaler Niereninsuffizienz (eGFR < 15 ml/min/1.73 m2) ist die Behandlung mit Kerendia mit Blick auf den Serumkaliumspiegel vorsichtig fortzusetzen, da die klinischen Erfahrungen begrenzt sind (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Kombinationstherapie
Bei allen Patienten, die bereits mit einem mässigen CYP3A4-Inhibitor behandelt werden, ist die Therapie mit Kerendia mit einer Anfangsdosis von 10 mg einmal täglich einzuleiten (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Körpergewicht
Eine Dosisanpassung auf Basis des Körpergewichts ist nicht erforderlich (siehe Rubrik «Pharmakokinetik»).
Ältere Patienten
Eine Dosisanpassung auf Basis des Alters ist nicht erforderlich (siehe Rubrik «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Kerendia bei Patienten unter 18 Jahren wurde nicht untersucht.
Verspätete Dosisgabe
Eine versäumte Dosis sollte so bald wie möglich eingenommen werden, jedoch nur am selben Tag. Um eine versäumte Dosis nachzuholen, sollte nicht die doppelte Dosis am selben Tag eingenommen werden.
Art der Anwendung
Zur oralen Anwendung.
Die Tabletten können mit einem Glas Wasser unabhängig von den Mahlzeiten eingenommen werden (siehe Rubrik «Pharmakokinetik»).
Die Einnahme von Kerendia zusammen mit Grapefruits oder Grapefruitsaft ist zu vermeiden (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Für Patienten, die nicht in der Lage sind, ganze Tabletten zu schlucken, können die Tabletten unmittelbar vor der Anwendung zerkleinert und mit Wasser oder dickflüssiger Kost (wie z.B. Apfelmus) eingenommen werden (siehe Rubrik «Pharmakokinetik»).
Kontraindikationen
Kerendia ist kontraindiziert bei Patienten:
- die eine Begleitbehandlung mit starken CYP3A4-Inhibitoren haben (z.B. Itraconazol, Ketoconazol, Ritonavir, Nelfinavir, Cobicistat, Clarithromycin, Telithromycin und Nefazodon) (siehe Rubrik «Interaktionen»).
- mit Morbus Addison.
- mit einer Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe (siehe Rubriken «Zusammensetzung» und «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und Vorsichtsmassnahmen
Hyperkaliämie
Hyperkaliämie wurde bei Patienten, die mit Kerendia behandelt wurden, beobachtet (siehe Rubrik «Unerwünschte Wirkungen»).
Einige Patienten tragen ein erhöhtes Risiko für die Entwicklung einer Hyperkaliämie. Risikofaktoren beinhalten erniedrigte eGFR, erhöhtes Serumkalium und frühere Episoden von Hyperkaliämie. Bei diesen Patienten sind häufigere Kontrollen in Betracht zu ziehen.
Eine Therapieeinleitung mit Kerendia wird nicht empfohlen, wenn der Serumkaliumspiegel > 5.0 mmol/l beträgt. Wenn der Serumkaliumspiegel > 4.8 bis 5.0 mmol/l beträgt, kann je nach Patientenmerkmalen und Serumkaliumspiegel eine Behandlung mit Kerendia in Betracht gezogen werden, wobei in den ersten 4 Wochen eine zusätzliche Überwachung des Serumkaliums erfolgen sollte (siehe Rubrik «Dosierung/Anwendung»).
Die Gabe von Kerendia bei behandelten Patienten ist auszusetzen, wenn der Serumkaliumspiegel > 5.5 mmol/l beträgt. Lokale Leitlinien für die Behandlung von Hyperkaliämie sind zu beachten. Die Behandlung mit Kerendia wird mit einer Dosierung von 10 mg einmal täglich wiederaufgenommen, wenn das Serumkalium ≤5.0 mmol/l beträgt (siehe Rubrik «Dosierung/Anwendung»).
Bei allen Patienten müssen Serumkalium und eGFR vier Wochen nach Einleitung, Wiederbeginn oder Auftitration der Behandlung mit Kerendia erneut gemessen werden. Danach soll die Messung des Serumkaliums periodisch und bei Bedarf auf der Grundlage der Patientenmerkmale und des Serumkaliumspiegels wiederholt werden (siehe Rubrik «Dosierung/Anwendung»).
Begleitbehandlung
Das Risiko für eine Hyperkaliämie kann auch bei Einnahme von Begleitmedikamenten, die den Serumkaliumspiegel erhöhen können, ansteigen (siehe Rubrik «Interaktionen»). Siehe auch «Gleichzeitige Anwendung von Substanzen, welche die Finerenon-Exposition beeinflussen».
Die gleichzeitige Anwendung von Kerendia mit folgenden Arzneimitteln ist zu vermeiden:
- kaliumsparende Diuretika (z.B. Amilorid, Triamteren)
- andere Mineralokortikoid-Rezeptor-Antagonisten (MRA) (z.B. Eplerenon, Esaxerenon, Spironolacton, Canrenon)
Kerendia ist mit Vorsicht anzuwenden und der Serumkaliumspiegel ist zu überwachen, wenn Kerendia gleichzeitig mit folgenden Arzneimitteln eingenommen wird:
- Kaliumsupplemente
- Trimethoprim oder Trimethoprim-Sulfamethoxazol. Eine vorübergehende Unterbrechung der Behandlung mit Kerendia kann erforderlich sein.
Nierenfunktionsstörung
Das Risiko für eine Hyperkaliämie steigt mit abnehmender Nierenfunktion. Eine kontinuierliche Überwachung der Nierenfunktion sollte nach Bedarf gemäss der Standardpraxis durchgeführt werden (siehe Rubrik «Dosierung/Anwendung»).
Eine Therapieeinleitung mit Kerendia wird bei Patienten mit eGFR < 25 ml/min/1.73 m2 aufgrund der begrenzten klinischen Erfahrungen nicht empfohlen (siehe Rubriken «Dosierung/Anwendung» und «Pharmakokinetik»).
Bei Patienten mit terminaler Niereninsuffizienz (eGFR < 15 ml/min/1.73 m2) ist die Behandlung mit Kerendia vorsichtig mit Blick auf den Serumkaliumspiegel fortzusetzen, da die klinischen Erfahrungen begrenzt sind (siehe Rubrik «Dosierung/Anwendung»).
Leberfunktionsstörung
Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) wurden nicht untersucht (siehe Rubrik «Pharmakokinetik»). Aufgrund eines erwarteten erheblichen Anstiegs der Finerenon-Exposition ist die Anwendung von Kerendia bei Patienten mit schwerer Leberinsuffizienz zu vermeiden (siehe Rubrik «Dosierung/Anwendung»).
Aufgrund eines Anstiegs der Finerenon-Exposition, ist bei Patienten mit mittelschwerer Leberinsuffizienz (Child-Pugh B) eine zusätzliche Überwachung des Serumkaliums in Betracht zu ziehen und die Überwachung je nach Patientenmerkmalen anzupassen (siehe Rubriken «Dosierung/Anwendung» und «Pharmakokinetik»).
Gleichzeitige Anwendung von Substanzen, welche die Finerenon-Exposition beeinflussen
Mässige und schwache CYP3A4-Inhibitoren
Bei gleichzeitiger Anwendung von Kerendia mit mässigen CYP3A4-Inhibitoren (z.B. Erythromycin und Verapamil) sowie schwachen CYP3A4-Inhibitoren (z.B. Amiodaron und Fluvoxamin) wird eine erhöhte Finerenon-Exposition erwartet (siehe Rubrik «Interaktionen»). Daher ist der Serumkaliumspiegel vor allem während der Einleitung der Behandlung mit oder bei Änderungen der Dosierung von Kerendia oder des CYP3A4-Inhibitors zu überwachen (siehe Rubrik «Dosierung/Anwendung»).
Starke und mässige CYP3A4-Induktoren
Die gleichzeitige Anwendung von Kerendia mit starken CYP3A4-Induktoren (z.B. Rifampicin, Carbamazepin, Phenytoin, Phenobarbital, Johanniskraut) oder mässigen CYP3A4-Induktoren (z.B. Efavirenz), die die Plasmakonzentrationen von Finerenon stark verringern und zu einer reduzierten therapeutischen Wirkung führen, ist zu vermeiden (siehe Rubrik «Interaktionen»). Die Anwendung eines alternativen Begleitmedikaments ohne oder mit schwachem Potenzial zur Induktion von CYP3A4 ist in Betracht zu ziehen.
Grapefruit
Die gleichzeitige Einnahme von Grapefruit oder Grapefruitsaft ist zu vermeiden, da dies die Plasmakonzentration von Finerenon erhöht (siehe Rubriken «Dosierung/Anwendung» und «Interaktionen»).
Informationen zu den Hilfsstoffen
Kerendia beinhaltet Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Kerendia beinhaltet Natrium. Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. es ist nahezu «natriumfrei».
Interaktionen
Interaktionsstudien wurden nur bei Erwachsenen durchgeführt. Finerenon wird fast ausschliesslich durch Cytochrom-P450- (CYP-)vermittelte oxidative Verstoffwechslung (hauptsächlich durch CYP3A4 [90 %] und zu einem geringen Anteil durch CYP2C8 [10 %]) eliminiert.
Wirkung anderer Arzneimittel auf Kerendia
Enzyminhibitoren
Starke CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Kerendia mit Itraconazol, Clarithromycin und anderen starken CYP3A4-Inhibitoren (z.B. Ketoconazol, Ritonavir, Nelfinavir (in der Schweiz nicht zugelassen), Cobicistat, Telithromycin (in der Schweiz nicht zugelassen) oder Nefazodon (in der Schweiz nicht zugelassen) ist kontraindiziert, da ein deutlicher Anstieg der Finerenon-Exposition zu erwarten ist (siehe Rubrik «Kontraindikationen»). Simulationen zeigen, dass die gleichzeitige Anwendung von Kerendia mit Itraconazol (200 mg zweimal täglich) die Finerenon-Exposition erhöht (geometrisches mittleres Verhältnis (GMR) und 90% Populationsintervall für AUC und Cmax: 6.31 [3.36-11.41] und 2.37 [1.76-3.31]). Clarithromycin (500 mg zweimal täglich) führt ebenfalls zum erwartungsgemässen Anstieg der Finerenon-Exposition (GMR und 90% Populationsintervall für AUC und Cmax: 5.28 [2.88-10.48] und 2.25 [1.76-2.98]).
Mässige CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Erythromycin (500 mg dreimal täglich), eines mässigen CYP3A4-Inhibitors, erhöhte die mittlere Finerenon-Exposition (GMR und 90% Konfidenzintervall für AUC und Cmax: 3.48 [3.02-4.02] und 1.88 [1.63-2.17]). Ein anderer mässiger CYP3A4-Inhibitor, Verapamil (240 mg-Tablette mit verzögerter Wirkstoffabgabe einmal täglich), erhöhte die mittlere Finerenon-Exposition (GMR und 90% Konfidenzintervall für AUC und Cmax: 2.70 [2.43-3.01] und 2.22 [1.88-2.62]). Da das Serumkalium damit ansteigen kann, muss der Serumkaliumspiegel überwacht werden (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Schwache CYP3A4-Inhibitoren
Simulationen deuten darauf hin, dass Fluvoxamin (100 mg zweimal täglich), ein schwacher CYP3A4-Inhibitor, die Finerenon-Exposition erhöht (GMR und 90% Populationsintervall für AUC und Cmax: 1.57 [1.25-2.08] und 1.38 [1.18-1.64]). Da das Serumkalium damit ansteigen kann, muss der Serumkaliumspiegel überwacht werden (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Grapefruit
Die gleichzeitige Aufnahme von Grapefruit oder Grapefruitsaft erhöht wahrscheinlich die Plasmakonzentration von Finerenon und sollte vermieden werden (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Enzyminduktoren
Die gleichzeitige Anwendung von Kerendia mit Rifampicin und anderen starken CYP3A4-Induktoren (z.B. Carbamazepin, Phenytoin, Phenobarbital, Johanniskraut) oder mit Efavirenz und anderen mässigen CYP3A4-Induktoren wird nicht empfohlen. Diese CYP3A4-Induktoren verringern die Plasmakonzentrationen von Finerenon deutlich und führen zu reduzierter therapeutischer Wirkung (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Simulationen deuten darauf hin, dass Rifampicin (600 mg einmal täglich), ein starker CYP3A4-Induktor, die Finerenon-Exposition verringert (GMR und 90% Populationsintervall für AUC und Cmax: 0.07 [0.05-0.11] und 0.14 [0.11-0.21]). Efavirenz (600 mg einmal täglich), ein mässiger CYP3A4-Induktor, verringert die Finerenon-Exposition (GMR und 90% Populationsintervall für AUC und Cmax: 0.19 [0.14-0.27] und 0.32 [0.23-0.43]).
Pharmakodynamische Interaktionen
Arzneimittel, die das Serumkalium erhöhen
Es ist zu erwarten, dass Arzneimittel, die das Serumkalium erhöhen, bei gleichzeitiger Anwendung mit Kerendia das Risiko für eine Hyperkaliämie erhöhen.
Die gleichzeitige Anwendung von Kerendia mit folgenden Arzneimitteln sollte vermieden werden:
- kaliumsparende Diuretika (z.B. Amilorid, Triamteren (in der Schweiz nicht zugelassen))
- andere Mineralokortikoid-Rezeptor-Antagonisten (MRA) (z.B. Eplerenon, Spironolacton, Esaxerenon (in der Schweiz nicht zugelassen), Canrenon (in der Schweiz nicht zugelassen))
Kerendia sollte bei gleichzeitiger Anwendung mit folgenden Arzneimitteln mit Vorsicht angewendet und der Serumkaliumspiegel muss während der Behandlung überwacht werden:
- Kaliumsupplemente
- Trimethoprim oder Trimethoprim-Sulfamethoxazol. Eine vorübergehende Unterbrechung der Behandlung mit Kerendia kann erforderlich sein (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Wirkung von Kerendia auf andere Arzneimittel
In vivo hatte ein Mehrdosisschema von 20 mg Finerenon einmal täglich keine Auswirkung auf die AUC des CYP3A4-Probesubstrats Midazolam. Finerenon bewirkt weder eine Hemmung noch eine Induktion von CYP3A4.
Eine Einzeldosis von 20 mg Finerenon hatte ebenfalls keine Auswirkung auf die AUC und Cmax des CYP2C8-Probesubstrats Repaglinid. Finerenon hemmt CYP2C8 nicht.
Es wurde keine gegenseitige pharmakokinetische Wechselwirkung zwischen Finerenon und dem CYP2C9-Substrat Warfarin sowie zwischen Finerenon und dem P-gp-Substrat Digoxin nachgewiesen.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen, die schwanger werden können, sollten während der Behandlung mit Kerendia eine wirksame Kontrazeption anwenden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Kerendia bei Schwangeren vor. Tierexperimentelle Studien haben eine embryofetale Entwicklungstoxizität nach Expositionen gezeigt, die über der maximalen Exposition beim Menschen liegen (siehe Rubrik «Präklinische Daten»).
Kerendia sollte nicht während der Schwangerschaft angewendet werden, es sei denn, dass eine Behandlung mit Finerenon aufgrund des klinischen Zustandes der Frau erforderlich ist.
Stillzeit
Es ist nicht bekannt, ob Finerenon oder seine Metaboliten in die menschliche Muttermilch übergehen. Verfügbare pharmakokinetische und toxikologische Daten bei Tieren haben eine Ausscheidung von Finerenon und seiner Metaboliten in die Milch gezeigt (siehe Rubrik «Präklinische Daten»). Ein Risiko für gestillte Neugeborene und Kleinkinder kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Kerendia verzichtet werden soll. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Fertilität
Es liegen keine Daten zur Wirkung von Kerendia auf die humane Fertilität vor. Tierexperimentelle Studien mit Finerenon ergaben keine klinisch relevanten Hinweise auf ein Risiko für eine beeinträchtigte Fertilität (siehe Rubrik «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Basierend auf dem Sicherheitsprofil von Kerendia wird kein Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, erwartet.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von Kerendia bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes wurde in der pivotalen Phase-III-Studie FIDELIO-DKD beurteilt. In dieser Studie erhielten 2827 Patienten Kerendia (10 mg oder 20 mg einmal täglich) und 2831 Patienten ein Placebo. Bei den Patienten in der Kerendia-Gruppe betrug die mittlere Behandlungsdauer 2.2 Jahre.
Die am häufigsten (≥10 %) berichtete unerwünschte Arzneimittelwirkung von Kerendia war Hyperkaliämie (siehe «Beschreibung ausgewählter unerwünschter Arzneimittelwirkungen» unten und Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Liste der unerwünschten Arzneimittelwirkungen
Die mit Kerendia beobachteten unerwünschten Arzneimittelwirkungen sind in der folgenden Tabelle 2 nach MedDRA-Systemorganklassen und Häufigkeitskategorien zusammengefasst. Die unerwünschten Arzneimittelwirkungen werden nach Systemorganklasse und in absteigender Häufigkeitsreihenfolge unter Verwendung der folgenden Konvention aufgeführt: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000) und sehr selten (<1/10'000).
Tabelle 2: Unerwünschte Arzneimittelwirkungen
MedDRA-Systemorganklasse | Sehr häufig | Häufig |
Stoffwechsel- und Ernährungsstörungen | Hyperkaliämie1 | Hyponatriämie2 |
Gefässerkrankungen | Hypotonie3, 4 | |
Untersuchungen | Glomeruläre Filtrationsrate verringert5 | |
1 Umfasst erhöhtes Blutkalium und Hyperkaliämie 2 Umfasst verringertes Blutnatrium und Hyponatriämie 3 Umfasst verminderter Blutdruck, diastolisch verminderter Blutdruck, diastolische Hypotonie und Hypotonie 4 Bei den mit Kerendia behandelten Patienten nahm nach 1 Monat der mittlere systolische Blutdruck (SBP) um 3 mmHg und der mittlere diastolische Blutdruck (DBP) um 1–2 mmHg ab und blieb danach stabil. Die meisten hypotensiven Ereignisse waren leicht oder mittelschwer ausgeprägt und klangen spontan ab. Mit Hypotonie assoziierte Ereignisse, wie z.B. Schwindel, Synkope oder Sturz, traten bei Patienten unter Kerendia nicht häufiger auf als unter Placebo. 5 Eine initiale Abnahme der eGFR (im Mittel um 2 ml/min/1.73 m2) wurde im Laufe der Zeit schwächer im Vergleich zum Placebo. Diese Abnahme hat sich nach Absetzen der Behandlung als reversibel erwiesen (siehe Rubrik «Eigenschaften/Wirkungen»). | ||
Beschreibung ausgewählter unerwünschter Arzneimittelwirkungen
Hyperkaliämie
In der Studie FIDELIO-DKD wurden bei 18.3 % der mit Kerendia behandelten Patienten Hyperkaliämie-Ereignisse berichtet, verglichen mit 9.0 % der mit Placebo behandelten Patienten. Bei den mit Kerendia behandelten Patienten waren die meisten Hyperkaliämie-Ereignisse leicht bis mittelschwer ausgeprägt. Der Anteil an Hospitalisierungen wegen Hyperkaliämie lag für die Finerenon-Gruppe bei 1.4 % versus 0.3 % in der Placebogruppe. Die Häufigkeit von Hyperkaliämie, die zum dauerhaften Absetzen des Prüfpräparates führte, betrug bei Patienten unter Finerenon 2.3 % versus 0.9 % in der Placebogruppe.
Ein Anstieg des mittleren Serumkaliumspiegels von ca. 0.2 mmol/l gegenüber dem Ausgangswert wurde im ersten Behandlungsmonat im Kerendia-Arm verglichen mit Placebo beobachtet, wobei ein maximaler Unterschied von 0.23 mmol/l zwischen den Gruppen nach 4 Monaten beobachtet wurde, der danach stabil blieb (siehe Rubrik «Eigenschaften/Wirkungen»). Zu besonderen Empfehlungen siehe Rubriken «Dosierung/Anwendung» sowie «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es wurden keine Fälle von unerwünschten Ereignissen im Zusammenhang mit Überdosierung von Kerendia beim Menschen berichtet. Als wahrscheinlichstes Anzeichen einer Überdosierung ist Hyperkaliämie zu erwarten. Bei Entwicklung einer Hyperkaliämie sollte die Standardbehandlung gemäss lokalen Leitlinien eingeleitet werden. Die Behandlung mit Kerendia sollte gemäss Tabelle 1 weitergeführt werden (siehe Rubrik «Dosierung/Anwendung»).
Es ist unwahrscheinlich, dass Finerenon durch Hämodialyse effizient eliminiert wird, da die an Plasmaproteine gebundenen Fraktion etwa 90 % beträgt.
Eigenschaften/Wirkungen
ATC-Code
C03DA05
Wirkungsmechanismus
Finerenon ist ein nichtsteroidaler, selektiver Antagonist des Mineralokortikoid-Rezeptors (MR) und schwächt die durch eine MR-Überaktivierung vermittelte Entzündung und Fibrose wirksam ab. Der MR wird in Nieren, Herz und Blutgefässen exprimiert, wo Finerenon auch der Natriumretention und hypertrophen Prozessen entgegenwirkt. Finerenon hat aufgrund seiner nichtsteroidalen Struktur und seines sperrigen Bindungsmodus eine hohe Potenz und Selektivität für den MR. Finerenon hat keine relevante Affinität für Androgen-, Progesteron-, Östrogen- sowie Glukokortikoidrezeptoren und verursacht daher keine geschlechtshormonbedingten Nebenwirkungen (wie z.B. Gynäkomastie). Seine Bindung an den MR führt zu einem spezifischen Rezeptor-Ligand-Komplex, der die Rekrutierung von transkriptionellen Koaktivatoren blockiert, die an der Expression von proinflammatorischen und profibrotischen Mediatoren beteiligt sind.
Pharmakodynamik
Wirkungen bei gesunden Probanden
Finerenon (Mehrfachdosen von 10 mg und 20 mg zweimal täglich oder 40 mg einmal täglich über 10 Tage) hatte bei gesunden männlichen Probanden keine anhaltende Wirkung auf die Natriurese oder das Kalium im Urin. Diese Anwendungsschemata führten zur Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS), d.h. zu reversiblen Anstiegen der Plasma-Renin-Aktivität und der Serumaldosteronkonzentrationen, wobei innerhalb von 48 Stunden nach der letzten Dosis wieder die Ausgangswerte erreicht wurden.
Nach Aktivierung des MR mit dem MR-Agonisten Fludrocortison (0.5 mg) zeigte Finerenon (Einzeldosen von 2.5, 5, 10, 20 mg PEG-Lösung oder 20-mg-Tabletten) jedoch dosisabhängige natriuretische Wirkungen bei gesunden männlichen Probanden. Darüber hinaus verringerte Finerenon (in Dosen von 5 bis 20 mg) erheblich die Kaliumausscheidung im Urin verglichen mit Placebo.
Einzel- oder Mehrfachdosen von Finerenon hatten bei gesunden Probanden keinen Einfluss auf die Vitalzeichen.
Wirkungen bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes
In FIDELIO-DKD, einer randomisierten, doppelblinden, placebokontrollierten, multizentrischen Studie der Phase III an Erwachsenen mit chronischer Nierenkrankheit und Typ-2-Diabetes betrug die placebokorrigierte relative Reduktion des Albumin-Kreatinin-Quotienten im Urin (UACR) bei Patienten, die randomisiert einer Behandlung mit Finerenon zugeteilt waren, nach 4 Monaten 31 %, und der UACR blieb während der gesamten Studie auf niedrigerem Niveau.
Kardiale Elektrophysiologie
Eine eingehende QT-Studie mit 57 gesunden Probanden ergab keine Hinweise auf eine QT/QTc-verlängernde Wirkung von Finerenon nach Einzeldosen von 20 mg (therapeutisch) oder 80 mg (supratherapeutisch), was darauf hindeutet, dass Finerenon keine Wirkung auf die kardiale Repolarisation hat.
Klinische Wirksamkeit
Die FIDELIO-DKD Studie war eine randomisierte, doppelblinde, placebokontrollierte, multizentrische Phase-III-Studie zur Untersuchung der Wirkung von Finerenon verglichen mit Placebo auf renale und kardiovaskuläre Ergebnisse bei erwachsenen Patienten mit Typ-2-Diabetes und chronischer Nierenerkrankung (Einschlusskriterien: a) moderate Albuminurie [UACR ≥30 - < 300 mg/g] und eGFR 25 - 60 ml/min/1.73 m2 bei gleichzeitigem Vorliegen einer diabetischen Retinopathie ODER b) schwere Albuminurie [UACR ≥300 mg/g] und eGFR 25 – 75 ml/min/1.73 m2). In die Studie eingeschlossene Patienten mussten einen Serumkaliumspiegel von ≤4.8 mmol/l aufweisen und eine Vorbehandlung mit einer Standardtherapie, inklusive einer maximal verträglichen Dosis eines Angiotensin-Converting-Enzyme-Hemmers (ACEI [34 %]) oder eines Angiotensinrezeptorblockers (ARB [66%]) erhalten. Patienten mit chronischer Herzinsuffizienz in den NYHA Klassen II – IV waren von der Studie ausgeschlossen.
Der primäre Endpunkt der FIDELIO-DKD-Studie war zusammengesetzt aus der Zeit bis zum ersten Auftreten eines Nierenversagens (definiert als chronische Dialyse, Nierentransplantation oder Abfall der eGFR auf < 15 ml/min/1.73 m2 über mindestens vier Wochen), einer Abnahme der eGFR um ≥40 % gegenüber dem Ausgangswert über mindestens vier Wochen oder eines nierenbedingten Todes. Sekundärer Schlüsselendpunkt war ein zusammengesetzter kardiovaskulärer Endpunkt bestehend aus der Zeit bis zum ersten Auftreten von kardiovaskulärem (KV) Tod, nichttödlichem Myokardinfarkt (MI), nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz.
Die Studie untersuchte 5674 Patienten, welche im Verhältnis 1:1 für die Behandlung mit Finerenon einmal täglich (n = 2833) oder Placebo (n = 2841) randomisiert wurden. Die Anfangsdosis betrug entweder 10 mg [bei einer eGFR von 25 - < 60 ml/min/1.73 m2] oder 20 mg [bei einer eGFR von ≥60 ml/min/1.73 m2]. Die Dosisstärke wurde im Verlauf der Studie auf 10 mg oder 20 mg QD, hauptsächlich auf Grund des Serumkaliumspiegels, angepasst. Die mediane Beobachtungsdauer betrug 2.6 Jahre. Die Studienpopulation war zu 63 % weisser, zu 25 % asiatischer und zu 5 % schwarzer Abstammung. Das mittlere Alter bei der Rekrutierung betrug 66 Jahre, und 70 % der Patienten waren Männer. Der mittlere eGFR-Ausgangswert betrug 44.3 ml/min/1.73 m2 und 55 % der Patienten hatten eine eGFR < 45 ml/min/1.73 m2. Der mediane UACR betrug 852 mg/g, das mittlere glykierte Hämoglobin A1c (HbA1c) betrug 7.7 %. Zirka 46 % der Studienteilnehmer hatten eine atherosklerotische kardiovaskuläre Vorerkrankung, 30 % eine koronare Herzkrankheit und 8 % eine Herzinsuffizienz in der Anamnese. Der mittlere Blutdruck betrug 138/76 mmHg. Die mittlere Dauer seit Diagnose des Typ-2-Diabetes bei Aufnahme in die Studie betrug 16.6 Jahre, und bei Studienbeginn erhielten nahezu alle Studienteilnehmer (97%) ein oder mehrere Antidiabetika (Insulin [64 %], Biguanide [44 %], Glucagon-like-Peptid-1-[GLP-1-]Rezeptoragonisten [7 %], Natrium-Glukose-Cotransporter-2-[SGLT2-]Inhibitoren [5 %]). Ausserdem wiesen 47 % bzw. 26 % der Patienten zu Studienbeginn eine vorbestehende diabetische Retinopathie und diabetische Neuropathie auf. Der Grossteil der Patienten erhielt zusätzlich ein Statin (74 %) und/oder einen Calciumantagonisten (63 %).
Die FIDELIO-DKD Studie zeigte eine Überlegenheit der Behandlung mit Finerenon gegenüber Placebo für den kombinierten (renalen) primären Endpunkt (HR 0.82, 95%-KI 0.73–0.93, p = 0.0014; siehe Tabelle 3 und Abbildung 1).
Ferner reduzierte Finerenon signifikant das Risiko für den kombinierten (kardiovaskulären) sekundären Schlüsselendpunkt (HR 0.86, 95%-KI 0.75–0.99, p = 0.0339; siehe Tabelle 3 und Abbildung 2). Im Finerenon-Arm ergaben sich im Vergleich zum Placebo-Arm niedrigere Inzidenzraten in Bezug auf Herzinsuffizienz, nichttödlichem Myokardinfarkt und kardiovaskulär bedingtem Tod. Nichttödliche Schlaganfälle traten in beiden Behandlungsarmen mit ähnlicher Inzidenz auf (siehe Tabelle 3).
Tabelle 3: Analyse der primären und wichtigsten sekundären Ereigniszeit-Endpunkte (und ihrer Einzelkomponenten) in der Phase-III-Studie FIDELIO-DKD
Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes | ||||||
Finerenon* | Placebo* | Behandlungseffekt | ||||
Primäre und sekundäre Ereigniszeit-Endpunkte: | n (%) | Ereignis- | n (%) | Ereignis- | Hazard Ratio | p-Wert |
Primärer kombinierter Endpunkt «Nierenversagen, anhaltende eGFR-Abnahme ≥40 % oder nierenbedingter Tod» | 504 (17.8 %) | 7.59 | 600 (21.1 %) | 9.08 | 0.82 [0.73; 0.93] | 0.0014 |
Nierenversagen | 208 (7.3 %) | 2.99 | 235 (8.3 %) | 3.39 | 0.87 [0.72; 1.05] | - |
Anhaltende eGFR-Abnahme ≥40 % | 479 (16.9 %) | 7.21 | 577 (20.3 %) | 8.73 | 0.81 [0.72; 0.92] | - |
Nierenbedingter Tod | 2 (< 0.1 %) | - | 2 (< 0.1 %) | - | - | - |
Sekundärer kombinierter Endpunkt «KV Tod, nichttödlicher MI, nichttödlicher Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz» | 367 (13.0 %) | 5.11 | 420 (14.8 %) | 5.92 | 0.86 [0.75; 0.99] | 0.0339 |
KV Tod | 128 (4.5 %) | 1.69 | 150 (5.3 %) | 1.99 | 0.86 [0.68; 1.08] | - |
Nichttödlicher MI | 70 (2.5 %) | 0.94 | 87 (3.1 %) | 1.17 | 0.80 [0.58; 1.09] | - |
Nichttödlicher Schlaganfall | 90 (3.2 %) | 1.21 | 87 (3.1 %) | 1.18 | 1.03 [0.76; 1.38] | - |
Hospitalisierung wegen Herzinsuffizienz | 139 (4.9 %) | 1.89 | 162 (5.7 %) | 2.21 | 0.86 [0.68; 1.08] | - |
* Behandlung zusätzlich zu maximal verträglichen zugelassenen Dosen von ACEI oder ARB.
Abbildung 1: Zeit bis zum ersten Auftreten von Nierenversagen, anhaltender eGFR-Abnahme ≥40 % vs. Ausgangswert oder nierenbedingtem Tod in der FIDELIO-DKD-Studie

Abbildung 2: Zeit bis zum ersten Auftreten von KV Tod, nichttödlichem MI, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz in der FIDELIO-DKD-Studie

Pharmakokinetik
Absorption
Finerenon wird nach oraler Verabreichung fast vollständig absorbiert. Die Absorption erfolgt rasch, und die maximalen Plasmakonzentrationen (Cmax) stellen sich 0.5 bis 1.25 Stunden nach Einnahme der Tablette im Nüchternzustand ein. Die absolute Bioverfügbarkeit von Finerenon beträgt 43.5 % aufgrund eines First-Pass-Metabolismus in Darmwand und Leber. Finerenon ist kein Substrat des Efflux-Transporters P-gp in vivo.
Die Aufnahme mit fett- und kalorienreicher Nahrung erhöhte die AUC von Finerenon um 21 %, reduzierte Cmax um 19 % und verlängerte die Zeit bis zum Erreichen von Cmax auf 2.5 Stunden. Dies ist klinisch nicht relevant. Daher kann Finerenon unabhängig von den Mahlzeiten eingenommen werden (siehe Rubrik «Dosierung/Anwendung»).
Distribution
Das Verteilungsvolumen von Finerenon im Steady State (Vss) beträgt 52.6 l. Die menschliche Plasmaproteinbindung von Finerenon in vitro beträgt 91.7 %; das Hauptbindungsprotein ist Serumalbumin.
Metabolismus
Etwa 90 % des Finerenon-Stoffwechsels werden durch CYP3A4 und 10 % durch CYP2C8 vermittelt. Vier Hauptmetaboliten (M-1a, M-1b, M-2a und M-3a) wurden im Plasma gefunden. Alle Metaboliten sind pharmakologisch inaktiv.
Elimination
Die Elimination von Finerenon aus dem Plasma erfolgt rasch mit einer Eliminationshalbwertszeit (t1/2) von etwa 2 bis 3 Stunden. Die Ausscheidung von unverändertem Finerenon stellt einen untergeordneten Ausscheidungsweg dar (< 1 % der Dosis im Urin durch glomeruläre Filtration, < 0.2 % in den Fäzes). Etwa 80 % der verabreichten Dosis wurden über den Urin und rund 20 % der Dosis wurden über die Fäzes ausgeschieden, und zwar fast ausschliesslich in Form von Metaboliten. Angesichts einer systemischen Clearance von etwa 25 l/h kann Finerenon als Wirkstoff mit niedriger Clearance eingestuft werden.
Linearität/Nicht Linearität
Die Pharmakokinetik von Finerenon ist über den untersuchten Dosisbereich von 1.25 bis 80 mg linear.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei Zirrhosepatienten mit leichter Leberinsuffizienz (Child-Pugh A) zeigte sich keine Veränderung der Finerenon-Exposition.
Bei Zirrhosepatienten mit mittelschwerer Leberinsuffizienz (Child-Pugh B) war die mittlere AUC von Finerenon um 38 % erhöht und Cmax war unverändert im Vergleich zu gesunden Kontrollprobanden (siehe Rubrik «Dosierung/Anwendung»).
Es liegen keine Daten für Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) vor (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Nierenfunktionsstörungen
Eine leichte Nierenfunktionsstörung (Kreatinin-Clearance [CLCR] 60 bis < 90 ml/min) hatte keinen Einfluss auf die AUC und Cmax von Finerenon. Im Vergleich zu Probanden mit normaler Nierenfunktion (CLCR ≥90 ml/min) war die Auswirkung einer mittelschweren (CLCR 30 bis < 60 ml/min) oder schweren (CLCR < 30 ml/min) Niereninsuffizienz auf die AUC von Finerenon mit Anstiegen von 34–36 % ähnlich hoch. Eine mittelschwere oder schwere Nierenfunktionsstörung hatte keine Auswirkungen auf die Cmax (siehe Rubrik «Dosierung/Anwendung»).
Aufgrund der hohen Plasmaproteinbindung ist zu erwarten, dass Finerenon nicht dialysierbar ist.
Ältere Patienten
58 % der 2827 Patienten, die Finerenon in der FIDELIO-DKD-Studie erhielten, waren 65 Jahre alt oder älter, und 15 % waren 75 Jahre alt oder älter. Zwischen diesen Patienten und jüngeren Patienten wurden insgesamt keine Unterschiede in der Sicherheit oder Wirksamkeit beobachtet.
Ältere Patienten (≥65 Jahre) wiesen höhere Plasmakonzentrationen von Finerenon auf als jüngere Patienten (≤45 Jahre), wobei die mittleren AUC- und Cmax-Werte bei den Älteren um 34 % bzw. 51 % höher waren (siehe Rubrik «Dosierung/Anwendung»).
Körpergewicht
In populationspharmakokinetischen Analysen erwies sich das Körpergewicht als Kovariate für Vc/F, was bei Probanden mit geringerem Körpergewicht zu höheren Finerenon Cmax-Werten führte. Die Cmax einer Person mit einem Körpergewicht von 50 kg war schätzungsweise um 43 % bis 51 % höher als bei einer Person mit 100 kg. Eine Dosisanpassung auf Basis des Körpergewichts ist nicht erforderlich (siehe Rubrik «Dosierung/Anwendung»).
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, akuten Toxizität und Phototoxizität, lassen die präklinischen Daten keine besonderen Gefahren bei klinisch relevanten Konzentrationen für den Menschen erkennen.
Wirkungen, die in Studien zur Toxizität bei wiederholter Verabreichung beobachtet wurden, waren hauptsächlich auf übersteigerte pharmakodynamische Aktivitäten von Finerenon und sekundäre adaptive Reaktionen zurückzuführen.
Reproduktionstoxizität
In Ratten wurde die männliche Fertilität durch Dosen bis zu 30 mg/kg/Tag Finerenon nicht beeinflusst (16-fach die AUCunbound beim Menschen). Finerenon verursachte eine reduzierte Fertilität in weiblichen Ratten (verringerte Anzahl an Corpora lutea und Implantationsstellen) sowie Zeichen einer frühen embryonalen Toxizität (erhöhte Postimplantationsverluste und verminderte Anzahl an lebensfähigen Feten) bei etwa dem 21-Fachen der AUCunbound beim Menschen. Ausserdem wurden bei etwa dem 17-Fachen der humanen AUCunbound reduzierte Ovarialgewichte festgestellt. Beim 10-Fachen der humanen AUCunbound wurden keine Wirkungen auf die weibliche Fertilität und die frühe embryonale Entwicklung beobachtet.
In den Studien zur embryofetalen Toxizität bei Ratten führte die orale Gabe von Finerenon zu reduziertem Plazentagewicht und Zeichen von embryofetaler Toxizität, darunter reduziertes Fetalgewicht und verzögerte Ossifikation ab der maternal toxischen Dosis von 10 mg/kg/Tag. Dies entsprach einer AUCunbound, die 19-fach über der klinischen Exposition liegt. Bei 30 mg/kg/Tag war die Inzidenz von viszeralen und skelettalen Veränderungen erhöht (leichtes Ödem, verkürzte Nabelschnur, leicht vergrösserte Fontanelle), und ein Fetus zeigte komplexe Fehlbildungen, einschliesslich einer seltenen Fehlbildung (doppelter Aortenbogen). Die AUCunbound liegt etwa 25-fach über der klinischen Exposition. Der NOAEL von 3 mg/kg/Tag (niedrige Dosis) bei Ratten ergab eine Sicherheitsspanne, die dem 10-Fachen der AUCunbound entsprach. Bei Kaninchen ergab der NOAEL von 2.5 mg/kg/Tag (hohe Dosis) eine Sicherheitsspanne, die dem 13-Fachen der AUCunbound entsprach.
In der Studie zur prä- und postnatalen Entwicklungstoxizität an Ratten wurden bei einer Dosis ab 3 mg/kg/Tag eine erhöhte Jungtiersterblichkeit und andere adverse Befunde (niedrigeres Jungtiergewicht, verzögerte Ohrmuschelentfaltung) beobachtet. Ausserdem zeigten die Jungtiere in diesen Dosisgruppen eine leicht gesteigerte lokomotorische Aktivität, jedoch keine weiteren neurologisch-verhaltensbezogenen Veränderungen ab einer AUCunbound, die etwa 4-fach über der klinischen Exposition lag. Der NOAEL von 1 mg/kg/Tag ergab eine Sicherheitsspanne, die etwa dem Zweifachen für die AUCunbound entsprach. Die erhöhte lokomotorische Aktivität bei Nachkommen könnte auf ein potenzielles Risiko für den Fetus hinweisen.
Genotoxizität
Im bakteriellen Mutagenesetest (Ames-Test) induzierte Finerenon keine Mutationen. Finerenon induzierte in vitro keine Chromosomenaberrationen in V79-Lungenzellen des Chinesischen Hamsters. Im Mikrokerntest bei männlichen Mäusen in vivo war Finerenon intraperitoneal in Konzentrationen von bis zu 1000 mg/kg/Tag nicht klastogen. Insgesamt zeigte Finerenon kein genotoxisches Potenzial.
Kanzerogenität
In 2-jährigen Kanzerogenitätsstudien zeigte eine orale Gabe von Finerenon kein kanzerogenes Potenzial bei männlichen und weiblichen Ratten sowie bei weiblichen Mäusen. Bei männlichen Mäusen führte Finerenon zu einem Anstieg von Leydigzelladenomen in einer Dosis von 30 mg/kg/Tag, welche einer AUCunbound entsprach, die 26-fach über der klinischen Exposition lag. Eine Dosis von 10 mg/kg/Tag, welche einer AUCunbound entsprach, die 17-fach über der klinischen Exposition lag, verursachte keine Tumore. Aufgrund der bekannten Empfindlichkeit von Nagern für die Entwicklung dieser Tumore sowie des pharmakologisch basierten Mechanismus bei supratherapeutischen Dosen und der ausreichenden Sicherheitsspannen wird die Zunahme von Leydigzelltumoren bei männlichen Mäusen nicht als klinisch relevant bewertet.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Nicht über 30°C lagern.
In der Originalverpackung aufbewahren.
Zulassungsnummer
68130 (Swissmedic).
Zulassungsinhaberin
Bayer (Schweiz) AG, Zürich
Stand der Information
August 2021
▼ Questo medicamento è soggetto a monitoraggio addizionale. Ciò consente una rapida identificazione delle nuove conoscenze in materia di sicurezza. Chi esercita una professione sanitaria è invitato a segnalare un nuovo o serio effetto collaterale sospetto. Per indicazioni a proposito della segnalazione di effetti collaterali, cfr. la rubrica «Effetti indesiderati».
Composizione
Principi attivi
Finerenonum.
Sostanze ausiliarie
Cellulosum microcristallinum, carmellosum natricum conexum, lactosum monohydricum, magnesii stearas, hypromellosum, natrii laurilsulfas.
Film di rivestimento: hypromellosum, talcum, titanii dioxidum (E 171), ferrum oxydatum rubrum (E 172) (presente solo nel dosaggio di 10 mg), ferrum oxydatum flavum (E 172) (presente solo nel dosaggio di 20 mg).
Una compressa rivestita con film da 10 mg contiene 0.44 mg di sodio e 42.75 mg di lattosio.
Una compressa rivestita con film da 20 mg contiene 0.47 mg di sodio e 38.00 mg di lattosio.
Forma farmaceutica e quantità di principio attivo per unità
Compresse rivestite con film da 10 mg e 20 mg di finerenone.
Aspetto
10 mg: compressa rivestita con film ovale, rosa, lunga 10 mm e larga 5 mm, con impresso «10» su un lato e «FI» sull'altro lato.
20 mg: compressa rivestita con film ovale, gialla, lunga 10 mm e larga 5 mm, con impresso «20» su un lato e «FI» sull'altro lato.
Indicazioni/Possibilità d'impiego
Kerendia è indicato per rallentare la progressione della malattia renale cronica in pazienti adulti affetti da diabete mellito di tipo 2 (cfr. le rubriche «Posologia/impiego» e «Efficacia clinica»).
Per i risultati degli studi relativi agli effetti sugli eventi cardiovascolari, cfr. la rubrica «Efficacia clinica».
Posologia/Impiego
Posologia abituale
La dose target raccomandata di Kerendia è di 20 mg una volta al giorno (corrispondente alla dose giornaliera massima).
Avvio della terapia
Kerendia deve essere utilizzato in aggiunta alla terapia standard (cfr. la rubrica «Efficacia clinica»).
Si raccomanda di avviare la terapia con Kerendia quando i livelli sierici di potassio sono ≤4.8 mmol/l. Per il monitoraggio del potassio sierico, cfr. «Terapia di mantenimento».
Quando i livelli sierici di potassio sono compresi tra > 4.8 e 5.0 mmol/l, è possibile considerare il trattamento con Kerendia in funzione delle caratteristiche del paziente e del livello di potassio sierico, tenendo conto che nelle prime 4 settimane sarà necessario un monitoraggio addizionale del potassio sierico (cfr. la rubrica «Avvertenze e misure precauzionali»).
Il trattamento con Kerendia non è consigliato in presenza di livelli sierici di potassio > 5.0 mmol/l (cfr. la rubrica «Avvertenze e misure precauzionali»).
La dose iniziale viene stabilita in base alla misurazione della velocità di filtrazione glomerulare stimata (eGFR). La dose iniziale di Kerendia è di:
- 20 mg una volta al giorno, con valori di eGFR ≥60 ml/min/1.73 m2
- 10 mg una volta al giorno, con valori di eGFR tra ≥25 e < 60 ml/min/1.73 m2
Alla luce della limitata esperienza clinica, non è consigliato avviare una terapia con Kerendia in pazienti con eGFR < 25 ml/min/1.73 m2.
Terapia di mantenimento
Il potassio sierico e la eGFR devono essere nuovamente misurati quattro settimane dopo l'avvio o la ripresa del trattamento o un incremento della dose di Kerendia. Per decidere sul proseguimento del trattamento con Kerendia e determinare l'adeguamento della dose, cfr. la tabella 1. Successivamente la misurazione del potassio sierico va ripetuta su base periodica e al bisogno in base alle caratteristiche del paziente e al livello di potassio sierico (cfr. le rubriche «Avvertenze e misure precauzionali» e «Interazioni»).
Tabella 1: Proseguimento (4 settimane dall'avvio o dalla ripresa del trattamento o da un incremento della dose) del trattamento con Kerendia e adeguamento della dose
Potassio sierico (mmol/l) | Posologia di Kerendia (dalla settimana 5) |
≤4.8 | Mantenere la posologia di 20 mg una volta al giorno. Nei pazienti con posologia di 10 mg una volta al giorno, aumentare la posologia a 20 mg una volta al giorno laddove la eGFR non sia scesa di > 30% rispetto alla misurazione precedente. |
tra > 4.8 e 5.5 | Mantenere la posologia. |
> 5.5 | Sospendere la somministrazione di Kerendia. Riprendere la somministrazione con 10 mg una volta al giorno quando il potassio sierico torna a livelli ≤5.0 mmol/l. |
Istruzioni posologiche speciali
Pazienti con disturbi della funzionalità epatica
Il trattamento con Kerendia va evitato nei pazienti con insufficienza epatica grave (Child-Pugh C) (cfr. le rubriche «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Nei pazienti con insufficienza epatica lieve o moderata (Child-Pugh A o B) non è necessario alcun adeguamento iniziale della dose (cfr. la rubrica «Farmacocinetica»).
Nei pazienti con insufficienza epatica moderata (Child-Pugh B) occorre prendere in considerazione un monitoraggio addizionale del potassio sierico, adeguando il monitoraggio in funzione delle caratteristiche del singolo paziente (cfr. le rubriche «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Pazienti con disturbi della funzionalità renale
Avvio della terapia
Per i pazienti con eGFR compresa tra ≥25 e < 60 ml/min/1.73 m2, la dose iniziale di Kerendia è di 10 mg una volta al giorno.
Alla luce della limitata esperienza clinica, non è consigliato avviare una terapia con Kerendia in pazienti con eGFR < 25 ml/min/1.73 m2 (cfr. le rubriche «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Terapia di mantenimento
La prosecuzione del trattamento e l'adeguamento della dose di Kerendia nei pazienti con disturbo della funzionalità renale di grado lieve, moderato o severo dipendono dal potassio sierico.
Per stabilire se la dose iniziale possa essere aumentata alla dose giornaliera raccomandata occorre determinare il valore di eGFR a 4 settimane dall'avvio del trattamento; cfr. tabella 1 e «Terapia di mantenimento».
Nei pazienti con insufficienza renale terminale (eGFR < 15 ml/min/1.73 m2), il trattamento con Kerendia deve essere proseguito con cautela monitorando i livelli di potassio sierico, poiché l'esperienza clinica è limitata (cfr. la rubrica «Avvertenze e misure precauzionali»).
Terapia combinata
In tutti i pazienti già in trattamento con un inibitore moderato del CYP3A4, la terapia con Kerendia deve essere avviata a una dose iniziale di 10 mg una volta al giorno (cfr. le rubriche «Avvertenze e misure precauzionali» e «Interazioni»).
Peso corporeo
Non sono necessari adeguamenti della dose in base al peso corporeo (cfr. la rubrica «Farmacocinetica»).
Pazienti anziani
Non sono necessari adeguamenti della dose in base all'età (cfr. la rubrica «Farmacocinetica»).
Bambini e adolescenti
La sicurezza e l'efficacia di Kerendia nei pazienti sotto i 18 anni non sono state esaminate.
Somministrazione ritardata della dose
Se viene dimenticata una dose, questa deve essere assunta il prima possibile, ma solo se ci si accorge della dimenticanza nello stesso giorno. Non si deve assumere una dose doppia nello stesso giorno per compensare la dimenticanza della dose.
Modo di somministrazione
Per uso orale.
Le compresse possono essere assunte con un bicchiere d'acqua indipendentemente dai pasti (cfr. la rubrica «Farmacocinetica»).
Si deve evitare l'assunzione di Kerendia insieme a pompelmo o succo di pompelmo (cfr. le rubriche «Avvertenze e misure precauzionali» e «Interazioni»).
Per i pazienti non in grado di deglutire compresse intere, le compresse di Kerendia possono essere frantumate immediatamente prima dell'uso e assunte con acqua o con cibi semisolidi (ad es. purea di mela) (cfr. la rubrica «Farmacocinetica»).
Controindicazioni
Kerendia è controindicato nei pazienti
- trattati in concomitanza con potenti inibitori del CYP3A4 (ad es. itraconazolo, ketoconazolo, ritonavir, nelfinavir, cobicistat, claritromicina, telitromicina e nefazodone) (cfr. la rubrica «Interazioni»).
- affetti da morbo di Addison.
- con ipersensibilità al principio attivo o a una delle sostanze ausiliarie (cfr. le rubriche «Composizione» e «Avvertenze e misure precauzionali»).
Avvertenze e misure precauzionali
Iperkaliemia
Tra i pazienti trattati con Kerendia è stata osservata iperkaliemia (cfr. la rubrica «Effetti indesiderati»).
Alcuni pazienti presentano un rischio maggiore di sviluppare iperkaliemia. I fattori di rischio comprendono bassi valori di eGFR, alti valori di potassio sierico ed episodi pregressi di iperkaliemia. Per questi pazienti occorre considerare controlli più frequenti.
Non è consigliato avviare una terapia con Kerendia in presenza di livelli sierici di potassio >5.0 mmol/l. Quando i livelli sierici di potassio sono compresi tra > 4.8 e 5.0 mmol/l, è possibile considerare il trattamento con Kerendia in funzione delle caratteristiche del paziente e del livello di potassio sierico, tenendo conto che nelle prime 4 settimane sarà necessario un monitoraggio addizionale del potassio sierico (cfr. la rubrica «Posologia/impiego»).
Qualora il livello di potassio sierico superi i 5.5 mmol/l in un paziente già trattato, è necessario sospendere la somministrazione di Kerendia. Osservare le linee guida locali per il trattamento dell'iperkaliemia. Una volta che il potassio sierico è tornato a livelli ≤5.0 mmol/l, il trattamento con Kerendia va ripreso alla posologia di 10 mg una volta al giorno (cfr. la rubrica «Posologia/impiego»).
Per tutti i pazienti è necessario rimisurare nuovamente il potassio sierico e la eGFR a quattro settimane dall'avvio o dalla ripresa del trattamento o da un incremento della dose di Kerendia. Successivamente la misurazione del potassio sierico va ripetuta su base periodica e al bisogno in base alle caratteristiche del paziente e al livello di potassio sierico (cfr. la rubrica «Posologia/impiego»).
Trattamento concomitante
Il rischio di iperkaliemia può aumentare anche in caso di assunzione concomitante di medicamenti che possono aumentare i livelli di potassio nel siero (cfr. la rubrica «Interazioni»). Cfr. anche «Utilizzo concomitante di sostanze che influiscono sull'esposizione a finerenone».
Evitare l'uso concomitante di Kerendia con i seguenti medicamenti:
- diuretici risparmiatori di potassio (ad es. amiloride, triamterene)
- altri antagonisti del recettore mineralcorticoide (MRA) (ad es. eplerenone, esaxerenone, spironolattone, canrenone)
Occorre cautela nell'uso di Kerendia e si deve monitorare il livello di potassio sierico quando Kerendia viene assunto in concomitanza con i seguenti medicamenti:
- integratori potassio
- trimetoprim o trimetoprim-sulfametossazolo. Può essere necessaria un'interruzione temporanea del trattamento con Kerendia.
Disturbo della funzionalità renale
Il rischio di iperkaliemia aumenta con la riduzione della funzionalità renale. È necessario un monitoraggio continuo della funzionalità renale, secondo necessità e secondo la prassi standard (cfr. la rubrica «Posologia/impiego»).
Alla luce della limitata esperienza clinica, non è consigliato avviare una terapia con Kerendia in pazienti con eGFR < 25 ml/min/1.73 m2 (cfr. le rubriche «Posologia/impiego» e «Farmacocinetica»).
Nei pazienti con insufficienza renale terminale (eGFR < 15 ml/min/1.73 m2), il trattamento con Kerendia deve essere proseguito con cautela monitorando i livelli di potassio sierico, poiché l'esperienza clinica è limitata (cfr. la rubrica «Posologia/impiego»).
Disturbo della funzionalità epatica
Non sono stati esaminati pazienti affetti da insufficienza epatica grave (Child Pugh C) (cfr. la rubrica «Farmacocinetica»). Poiché si prevede un marcato aumento dell'esposizione a finerenone, l'uso di Kerendia nei pazienti con grave insufficienza epatica deve essere evitato (cfr. la rubrica «Posologia/impiego»).
Per via dell'aumento dell'esposizione a finerenone, nei pazienti con insufficienza epatica moderata (Child-Pugh B) occorre prendere in considerazione un monitoraggio addizionale del potassio sierico, adeguando il monitoraggio in funzione delle caratteristiche del singolo paziente (cfr. le rubriche «Posologia/impiego» e «Farmacocinetica»).
Utilizzo concomitante di sostanze che influiscono sull'esposizione a finerenone
Inibitori moderati e deboli del CYP3A4
In caso di uso concomitante di Kerendia con inibitori del CYP3A4 sia moderati (ad es. eritromicina e verapamil) che deboli (ad es. amiodarone e fluvoxamina), si prevede un'aumentata esposizione a finerenone (cfr. la rubrica «Interazioni»). Sarà quindi necessario monitorare il livello di potassio nel siero, specialmente nella fase di avvio del trattamento o in occasione di modifiche della posologia di Kerendia o dell'inibitore del CYP3A4 (cfr. la rubrica «Posologia/impiego»).
Induttori potenti e moderati del CYP3A4
Si deve evitare l'uso concomitante di Kerendia con induttori del CYP3A4 potenti (ad es. rifampicina, carbamazepina, fenitoina, fenobarbital, erba di San Giovanni) o moderati (ad es. efavirenz), i quali riducono notevolmente le concentrazioni plasmatiche di finerenone determinando una riduzione dell'effetto terapeutico (cfr. la rubrica «Interazioni»). Va considerato il ricorso ad un medicamento concomitante alternativo, con potenziale di induzione del CYP3A4 nullo o debole.
Pompelmo
L'assunzione concomitante di pompelmo o succo di pompelmo deve essere evitata in quanto questa aumenta la concentrazione plasmatica di finerenone (cfr. le rubriche «Posologia/impiego» e «Interazioni»).
Informazioni sulle sostanze ausiliarie
Kerendia contiene lattosio. I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit totale di lattasi, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicamento.
Kerendia contiene sodio. Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa rivestita con film, cioè essenzialmente «senza sodio».
Interazioni
Sono stati effettuati studi di interazione solo negli adulti. Finerenone viene eliminato quasi esclusivamente attraverso il metabolismo ossidativo mediato dal citocromo P450 (CYP) (principalmente dal CYP3A4 [90%] e, in misura minore, dal CYP2C8 [10%]).
Effetto di altri medicamenti su Kerendia
Inibitori enzimatici
Inibitori potenti del CYP3A4
L'uso concomitante di Kerendia con itraconazolo, claritromicina ed altri potenti inibitori del CYP3A4 (ad es. ketoconazolo, ritonavir, nelfinavir (non omologato in Svizzera), cobicistat, telitromicina (non omologata in Svizzera) o nefazodone (non omologato in Svizzera) è controindicato, poiché si prevede un marcato aumento dell'esposizione a finerenone (cfr. la rubrica «Controindicazioni»). Le simulazioni mostrano che l'uso concomitante di Kerendia con itraconazolo (200 mg due volte al giorno) aumenta l'esposizione a finerenone (rapporto medio geometrico (GMR) e intervallo di popolazione al 90% per AUC e Cmax: 6.31 [3.36-11.41] e 2.37 [1.76-3.31]). Anche claritromicina (500 mg due volte al giorno) induce il previsto aumento dell'esposizione a finerenone (GMR e intervallo di popolazione al 90% per AUC e Cmax: 5.28 [2.88-10.48] e 2.25 [1.76-2.98]).
Inibitori moderati del CYP3A4
L'uso concomitante di eritromicina (500 mg tre volte al giorno), un inibitore moderato del CYP3A4, ha aumentato l'esposizione media a finerenone (GMR e intervallo di confidenza al 90% per AUC e Cmax: 3.48 [3.02-4.02] e 1.88 [1.63-2.17]). Un altro inibitore moderato del CYP3A4, verapamil (compressa da 240 mg a rilascio ritardato del principio attivo somministrata una volta al giorno), ha aumentato l'esposizione media a finerenone (GMR e intervallo di confidenza al 90% per AUC e Cmax: 2.70 [2.43-3.01] e 2.22 [1.88-2.62]). Poiché ciò può aumentare il potassio sierico, il livello sierico di potassio deve essere monitorato (cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Inibitori deboli del CYP3A4
Simulazioni suggeriscono che fluvoxamina (100 mg due volte al giorno), un debole inibitore del CYP3A4, aumenta l'esposizione a finerenone (GMR e intervallo di popolazione al 90% per AUC e Cmax: 1.57 [1.25-2.08] e 1.38 [1.18-1.64]). Poiché ciò può aumentare il potassio sierico, il livello sierico di potassio deve essere monitorato (cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Pompelmo
È probabile che la concomitante assunzione di pompelmo o succo di pompelmo aumenti la concentrazione di finerenone nel plasma e, pertanto, deve essere evitata (cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Induttori enzimatici
L'uso concomitante di Kerendia con rifampicina ed altri potenti induttori del CYP3A4 (ad es. carbamazepina, fenitoina, fenobarbital, erba di San Giovanni) o con efavirenz ed altri moderati induttori del CYP3A4 non è consigliato. Questi induttori del CYP3A4 riducono notevolmente le concentrazioni plasmatiche di finerenone determinando una riduzione dell'effetto terapeutico (cfr. la rubrica «Avvertenze e misure precauzionali»).
Simulazioni suggeriscono che rifampicina (600 mg una volta al giorno), un potente induttore del CYP3A4, diminuisce l'esposizione a finerenone (GMR e intervallo di popolazione al 90% per AUC e Cmax: 0.07 [0.05-0.11] e 0.14 [0.11-0.21]). Efavirenz (600 mg una volta al giorno), un moderato induttore del CYP3A4, riduce l'esposizione a finerenone (GMR e intervallo di popolazione al 90% per AUC e Cmax: 0.19 [0.14-0.27] e 0.32 [0.23-0.43]).
Interazioni farmacodinamiche
Medicamenti che aumentano il potassio sierico
È prevedibile che l'uso concomitante di Kerendia con medicamenti che aumentano il potassio sierico aumenti il rischio di iperkaliemia.
Si deve evitare l'uso concomitante di Kerendia con i seguenti medicamenti:
- diuretici risparmiatori di potassio (ad es. amiloride, triamterene (non omologato in Svizzera))
- altri antagonisti del recettore mineralcorticoide (MRA) (ad es. eplerenone, spironolattone, esaxerenone (non omologato in Svizzera), canrenone (non omologato in Svizzera))
In concomitanza con i seguenti medicamenti, l'uso di Kerendia richiede cautela e il livello di potassio sierico deve essere monitorato per tutta la durata del trattamento:
- integratori potassio
- trimetoprim o trimetoprim-sulfametossazolo. Può essere necessaria un'interruzione temporanea del trattamento con Kerendia (cfr. la rubrica «Avvertenze e misure precauzionali»).
Effetto di Kerendia su altri medicamenti
Un regime a dosi multiple da 20 mg di finerenone somministrato una volta al giorno non ha avuto alcun effetto sull'AUC di midazolam usato come substrato di prova per CYP3A4 in vivo: finerenone non causa né inibizione né induzione del CYP3A4.
Una singola dose da 20 mg di finerenone non ha avuto effetti neppure sull'AUC e sulla Cmax di repaglinide usato come substrato di prova per CYP2C8: finerenone non inibisce il CYP2C8.
Non sono state dimostrate interazioni farmacocinetiche reciproche tra finerenone e warfarin, substrato del CYP2C9, e nemmeno tra finerenone e digossina, substrato della P-gp.
Gravidanza/Allattamento
Donne in età fertile
Le donne che possono iniziare una gravidanza devono utilizzare una contraccezione efficace per tutta la durata del trattamento con Kerendia.
Gravidanza
Non sono disponibili dati sull'utilizzo di Kerendia in donne in gravidanza. Studi sperimentali sugli animali hanno mostrato una tossicità per lo sviluppo embriofetale a seguito di esposizioni superiori alla massima esposizione nell'uomo (cfr. la rubrica «Dati preclinici»).
Kerendia non deve essere usato durante la gravidanza, a meno che le condizioni cliniche della donna non richiedano il trattamento con finerenone.
Allattamento
Non è noto se nell'essere umano finerenone o i suoi metaboliti passino nel latte materno. I dati farmacocinetici e tossicologici disponibili in animali hanno mostrato l'escrezione di finerenone e dei suoi metaboliti nel latte (cfr. la rubrica «Dati preclinici»). Non può essere escluso un rischio per i neonati e bambini piccoli allattati al seno. Deve essere presa la decisione se interrompere l'allattamento o se rinunciare al trattamento con Kerendia, tenendo in considerazione sia il beneficio dell'allattamento per il bambino sia il beneficio della terapia per la donna.
Fertilità
Non sono disponibili dati sull'effetto di Kerendia sulla fertilità umana. Gli studi sperimentali sugli animali con finerenone non hanno prodotto evidenze clinicamente rilevanti di un rischio di compromissione della fertilità (cfr. la rubrica «Dati preclinici»).
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Sulla base del profilo di sicurezza di Kerendia non si prevede che il medicamento abbia effetti sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine.
Effetti indesiderati
Riassunto del profilo di sicurezza
La sicurezza di Kerendia in pazienti con malattia renale cronica e diabete mellito di tipo 2 è stata valutata nello studio pivotal di fase III FIDELIO-DKD. Tra i pazienti inclusi in questo studio, 2827 hanno ricevuto Kerendia (10 mg o 20 mg una volta al giorno) e 2831 un placebo. La durata media del trattamento per i pazienti nel gruppo Kerendia è stata di 2.2 anni.
L'effetto indesiderato del medicamento riportato più frequentemente per Kerendia (≥10%) è stata l'iperkaliemia (cfr. «Descrizione di effetti indesiderati selezionati» di seguito e la rubrica «Avvertenze e misure precauzionali»).
Elenco degli effetti indesiderati
Gli effetti indesiderati del medicamento osservati con l'uso di Kerendia sono riepilogati di seguito nella tabella 2, secondo la classificazione sistemica organica MedDRA e per categoria di frequenza. Gli effetti indesiderati del medicamento vengono presentati per classe sistemica organica e in ordine decrescente di frequenza utilizzando la seguente convenzione: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1000, <1/100), raro (≥1/10 000, <1/1000) e molto raro (<1/10 000).
Tabella 2: Effetti indesiderati del medicamento
Classe sistemica organica MedDRA | Molto comune | Comune |
Disturbi del metabolismo e della nutrizione | Iperkaliemia1 | Iponatriemia2 |
Patologie vascolari | Ipotensione3, 4 | |
Esami diagnostici | Velocità di filtrazione glomerulare ridotta5 | |
1 Comprende potassio ematico aumentato e iperkaliemia 2 Comprende sodio ematico diminuito e iponatriemia 3 Comprende pressione arteriosa ridotta, pressione diastolica ridotta, ipotensione diastolica e ipotensione 4 Nei pazienti trattati con Kerendia i valori medi di pressione arteriosa sistolica (SBP) e pressione arteriosa diastolica (DBP) sono diminuiti rispettivamente di 3 mmHg e 1-2 mmHg dopo 1 mese di terapia, per poi rimanere stabili. Per la maggior parte, gli eventi ipotensivi erano di natura lieve o moderata e si sono risolti spontaneamente. La frequenza di eventi associati all'ipotensione, come ad es. capogiro, sincope o caduta, non è stata superiore nei pazienti trattati con Kerendia rispetto al placebo. 5 L'iniziale riduzione della eGFR (mediamente di 2 ml/min/1.73 m2) è rallentata nel corso del tempo rispetto al placebo. Tale riduzione si è dimostrata reversibile con l'interruzione del trattamento (cfr. la rubrica «Proprietà/effetti»). | ||
Descrizione di effetti indesiderati selezionati
Iperkaliemia
Nello studio FIDELIO-DKD sono stati riportati eventi di iperkaliemia nel 18.3% dei pazienti trattati con Kerendia rispetto al 9.0% dei pazienti trattati con placebo. Gli eventi di iperkaliemia nei pazienti trattati con Kerendia sono stati per la maggior parte di natura lieve o moderata. Il tasso di ospedalizzazioni per iperkaliemia è stato dell'1.4% nel gruppo finerenone rispetto allo 0.3% nel gruppo placebo. La frequenza di iperkaliemia che ha determinato l'interruzione definitiva del preparato sperimentale è stata del 2.3% nei pazienti trattati con finerenone rispetto allo 0.9% nel gruppo placebo.
In confronto al placebo, per il braccio Kerendia è stato osservato nel primo mese di trattamento un aumento del livello medio di potassio sierico pari a ca. 0.2 mmol/l rispetto al basale; la differenza massima rilevata tra i gruppi è risultata di 0.23 mmol/l dopo 4 mesi ed rimasta stabile successivamente (cfr. la rubrica «Proprietà/effetti»). Per le raccomandazioni specifiche, cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali».
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi effetto indesiderato sospetto, nuovo o serio, attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Non sono stati segnalati casi di eventi indesiderati associati al sovradosaggio con Kerendia nell'uomo. Come segno più probabile di un sovradosaggio è da attendersi iperkaliemia. In caso di sviluppo di iperkaliemia, si dovrà avviare il trattamento standard secondo le linee guida locali. Il trattamento con Kerendia va proseguito come indicato nella tabella 1 (cfr. la rubrica «Posologia/impiego»).
Considerando la frazione legata alle proteine plasmatiche, pari a circa il 90%, è improbabile che finerenone venga efficacemente eliminato tramite emodialisi.
Proprietà/Effetti
Codice ATC
C03DA05
Meccanismo d'azione
Finerenone è un antagonista selettivo non steroideo del recettore mineralcorticoide (MR) che riduce efficacemente l'infiammazione e la fibrosi mediate dall'iperattivazione del MR. MR viene espresso nel rene, nel cuore e nei vasi sanguigni, dove finerenone interviene contrastando anche la ritenzione di sodio e i processi ipertrofici. In virtù della sua struttura non steroidea e della modalità di rilegatura ingombrante, finerenone è dotato di elevata potenza e selettività nei confronti di MR. Finerenone non presenta affinità rilevanti per i recettori androgenici, progestinici, estrogenici o glucocorticoidi e, pertanto, non causa gli effetti collaterali degli ormoni sessuali (ad es. ginecomastia). Il suo legame con MR porta alla formazione di uno specifico complesso ligando-recettore che blocca il reclutamento di coattivatori trascrizionali coinvolti nell'espressione di mediatori proinfiammatori e profibrotici.
Farmacodinamica
Effetti nei soggetti sani
Finerenone (dosi multiple di 10 mg e 20 mg due volte al giorno o 40 mg una volta al giorno per 10 giorni) non ha avuto alcun effetto sostenuto sulla natriuresi o sul potassio urinario quando somministrato a soggetti sani di sesso maschile. Questi regimi di somministrazione hanno determinato l'attivazione del sistema renina-angiotensina-aldosterone (RAAS), ossia aumenti reversibili dell'attività della renina plasmatica e delle concentrazioni sieriche di aldosterone, con un ritorno a valori basali entro 48 ore dall'ultima dose.
Tuttavia, in seguito all'attivazione di MR da parte dell'agonista mineralcorticoide fludrocortisone (0.5 mg), finerenone (dosi singole di 2.5, 5, 10, 20 mg in forma di soluzione PEG o compresse da 20 mg) ha mostrato effetti natriuretici dose-dipendenti nei soggetti sani di sesso maschile. Paragonato al placebo, finerenone (a dosi comprese tra 5 e 20 mg) ha inoltre indotto una notevole riduzione dell'escrezione di potassio nelle urine.
Dosi singole o multiple di finerenone non hanno avuto alcun effetto sui segni vitali in soggetti sani.
Effetti nei pazienti con malattia renale cronica e diabete mellito di tipo 2
Nello studio FIDELIO-DKD, uno studio di fase III, multicentrico, randomizzato, in doppio cieco, controllato con placebo, condotto su adulti affetti da malattia renale cronica e diabete mellito di tipo 2, la riduzione relativa del rapporto albumina/creatinina nelle urine (UACR) corretto per il placebo nei pazienti randomizzati al trattamento con finerenone è risultata pari al 31% dopo 4 mesi di terapia, e il rapporto UACR si è mantenuto su livelli bassi per tutta la durata dello studio.
Elettrofisiologia cardiaca
Uno studio specifico sul QT effettuato con 57 soggetti sani non ha fornito evidenze di un effetto di prolungamento del QT/QTc ad opera di finerenone in seguito a dosi singole da 20 mg (terapeutiche) o 80 mg (sovraterapeutiche), ad indicare che finerenone non ha alcun effetto sulla ripolarizzazione cardiaca.
Efficacia clinica
FIDELIO-DKD è stato uno studio di fase III, multicentrico, randomizzato, in doppio cieco, controllato con placebo effettuato per esaminare l'effetto di finerenone rispetto al placebo in termini di risultati renali e cardiovascolari in pazienti adulti affetti da diabete mellito di tipo 2 e malattia renale cronica (criteri di inclusione: a) albuminuria moderata [UACR tra ≥30 e < 300 mg/g] e valori di eGFR tra 25 e 60 ml/min/1.73 m2 in compresenza di retinopatia diabetica OPPURE b) albuminuria grave [UACR ≥300 mg/g] e valori di eGFR tra 25 e 75 ml/min/1.73 m2). I pazienti inclusi nello studio dovevano presentare un livello sierico di potassio ≤4.8 mmol/l ed essere stati precedentemente trattati con una terapia standard, compresa la dose massima tollerabile di un inibitore dell'enzima di conversione dell'angiotensina (ACEI [34%]) o di un bloccante del recettore dell'angiotensina (ARB [66%]). I pazienti con insufficienza cardiaca cronica di classe NYHA II-IV sono stati esclusi dallo studio.
L'endpoint primario dello studio FIDELIO-DKD era un composito di tempo alla prima insorgenza di insufficienza renale (definita come dialisi cronica, trapianto renale o riduzione della eGFR a < 15 ml/min/1.73 m2 sostenuta per almeno quattro settimane), riduzione della eGFR di ≥40% rispetto al basale sostenuta per almeno quattro settimane o morte per cause renali. L'endpoint chiave secondario era un endpoint cardiovascolare composito, consistente in tempo al primo verificarsi di morte cardiovascolare (CV), infarto miocardico (IM) non fatale, ictus non fatale o ospedalizzazione per insufficienza cardiaca.
Lo studio ha esaminato 5674 pazienti, randomizzati in rapporto 1:1 a ricevere il trattamento con finerenone una volta al giorno (n = 2833) o placebo (n = 2841). La dose iniziale era di 10 mg [in caso di eGFR compresa tra 25 e <60 ml/min/1.73 m2] o di 20 mg [in caso di eGFR ≥60 ml/min/1.73 m2]. Nel corso dello studio il dosaggio è stato aggiustato a 10 mg o 20 mg QD, principalmente in base ai livelli sierici di potassio. Il tempo mediano di osservazione è stato di 2.6 anni. La popolazione in studio era composta da bianchi per il 63%, asiatici per il 25% e neri per il 5%. L'età media al momento dell'arruolamento era di 66 anni, e il 70% dei pazienti era di sesso maschile. La eGFR media al basale era di 44.3 ml/min/1.73 m2 e il 55% dei pazienti aveva una eGFR < 45 ml/min/1.73 m2. L'UACR mediano era di 852 mg/g, il tasso medio di emoglobina glicata A1c (HbA1c) era del 7.7%. Circa il 46% dei partecipanti allo studio aveva in anamnesi una malattia cardiovascolare aterosclerotica pregressa, il 30% una coronaropatia e l'8% un'insufficienza cardiaca. La pressione arteriosa media era di 138/76 mmHg. Il tempo medio trascorso dalla diagnosi di diabete mellito di tipo 2 all'inclusione nello studio era di 16.6 anni, e all'inizio dello studio pressoché tutti i partecipanti (97%) erano in trattamento con uno o più antidiabetici (insulina [64%], biguanide [44%], agonisti del recettore del glucagon-like peptide-1 [GLP-1] [7%], inibitori del co-trasportatore sodio-glucosio di tipo 2 [SGLT2] [5%]). Inoltre, a inizio studio il 47% e il 26% dei pazienti presentavano già rispettivamente retinopatia diabetica e neuropatia diabetica. Per la maggior parte i pazienti erano trattati in via aggiuntiva con una statina (74%) e/o un calcio-antagonista (63%).
Lo studio FIDELIO-DKD ha dimostrato la superiorità del trattamento con finerenone rispetto al placebo per l'endpoint primario (renale) composito (HR 0.82, IC al 95% 0.73-0.93, p = 0.0014; cfr. tabella 3 e figura 1).
Inoltre finerenone ha ridotto significativamente il rischio per l'endpoint chiave secondario (cardiovascolare) composito (HR 0.86, IC al 95% 0.75-0.99, p = 0.0339; cfr. tabella 3 e figura 2). Nel braccio finerenone rispetto al braccio placebo sono stati riscontrati tassi di incidenza più bassi di insufficienza cardiaca, infarto miocardico non fatale e morte per cause cardiovascolari. L'incidenza di ictus non fatali è risultata simile nei due bracci di trattamento (cfr. la tabella 3).
Tabella 3: Analisi degli endpoint primari e dei principali endpoint secondari di tempo all'evento (e dei loro singoli componenti) nello studio di fase III FIDELIO-DKD
Pazienti con malattia renale cronica e diabete mellito di tipo 2 | ||||||
Finerenone* | Placebo* | Effetto del trattamento | ||||
Endpoint primari e secondari di tempo all'evento: | n (%) | Tasso di | n (%) | Tasso di | Hazard ratio | Valore p |
Endpoint primario composito di «insufficienza renale, riduzione sostenuta della eGFR ≥40% o morte per cause renali» | 504 (17.8%) | 7.59 | 600 (21.1%) | 9.08 | 0.82 [0.73; 0.93] | 0.0014 |
Insufficienza renale | 208 (7.3%) | 2.99 | 235 (8.3%) | 3.39 | 0.87 [0.72; 1.05] | - |
Riduzione sostenuta della eGFR ≥40% | 479 (16.9%) | 7.21 | 577 (20.3%) | 8.73 | 0.81 [0.72; 0.92] | - |
Morte per cause renali | 2 (<0.1%) | - | 2 (<0.1%) | - | - | - |
Endpoint secondario composito di «morte CV, IM non fatale, ictus non fatale o ospedalizzazione per insufficienza cardiaca» | 367 (13.0%) | 5.11 | 420 (14.8%) | 5.92 | 0.86 [0.75; 0.99] | 0.0339 |
Morte CV | 128 (4.5%) | 1.69 | 150 (5.3%) | 1.99 | 0.86 [0.68; 1.08] | - |
IM non fatale | 70 (2.5%) | 0.94 | 87 (3.1%) | 1.17 | 0.80 [0.58; 1.09] | - |
Ictus non fatale | 90 (3.2%) | 1.21 | 87 (3.1%) | 1.18 | 1.03 [0.76; 1.38] | - |
Ospedalizzazione per insufficienza cardiaca | 139 (4.9%) | 1.89 | 162 (5.7%) | 2.21 | 0.86 [0.68; 1.08] | - |
* Trattamento in aggiunta alle dosi massime tollerabili omologate di ACEI o ARB.
Figura 1: Tempo alla prima insorgenza di insufficienza renale, riduzione sostenuta della eGFR ≥40% rispetto al basale o morte per cause renali nello studio FIDELIO-DKD

Figura 2: Tempo al primo verificarsi di morte CV, IM non fatale, ictus non fatale o ospedalizzazione per insufficienza cardiaca nello studio FIDELIO-DKD

Farmacocinetica
Assorbimento
In seguito a somministrazione orale, finerenone è quasi completamente assorbito. L'assorbimento avviene rapidamente, con concentrazioni plasmatiche massime (Cmax) raggiunte tra 0.5 e 1.25 ore dall'assunzione della compressa in condizioni di digiuno. La biodisponibilità assoluta di finerenone è del 43.5%, dovuta al metabolismo di primo passaggio nella parete intestinale e nel fegato. Finerenone non è un substrato per il trasportatore di efflusso P-gp in vivo.
L'assunzione con cibo ad alto contenuto lipidico e calorico ha aumentato l'AUC di finerenone del 21%, ha ridotto la Cmax del 19% e ha prolungato il tempo necessario al raggiungimento della Cmax a 2.5 ore. Ciò non è rilevante a livello clinico, pertanto finerenone può essere assunto indipendentemente dai pasti (cfr. la rubrica «Posologia/impiego»).
Distribuzione
Il volume di distribuzione di finerenone allo stato stazionario (Vss) è di 52.6 l. Finerenone si lega alle proteine plasmatiche umane in vitro al 91.7%; la principale proteina di legame è l'albumina sierica.
Metabolismo
Il metabolismo di finerenone è mediato dal CYP3A4 approssimativamente per il 90% e dal CYP2C8 per il 10%. Nel plasma sono stati ritrovati quattro metaboliti principali (M-1a, M-1b, M-2a e M-3a), tutti farmacologicamente inattivi.
Eliminazione
L'eliminazione di finerenone dal plasma avviene rapidamente, con un'emivita di eliminazione (t1/2) di circa 2-3 ore. L'escrezione di finerenone immodificato rappresenta una via di eliminazione secondaria (<1% della dose nelle urine mediante filtrazione glomerulare, <0.2% nelle feci). La dose somministrata è stata escreta per via urinaria per circa l'80% e per via fecale per circa il 20%, e ciò quasi esclusivamente in forma di metaboliti. Con una clearance sistemica di circa 25 l/h, finerenone può essere classificato come un principio attivo a bassa clearance.
Linearità/non linearità
La farmacocinetica di finerenone è lineare nell'intervallo di dose preso in esame, da 1.25 a 80 mg.
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità epatica
Nei pazienti cirrotici con insufficienza epatica lieve (Child-Pugh A) non si è evidenziata alcuna variazione dell'esposizione a finerenone.
Nei pazienti cirrotici con insufficienza epatica moderata (Child-Pugh B) l'AUC media di finerenone è risultata aumentata del 38%, mentre la Cmax è rimasta inalterata rispetto ai controlli sani (cfr. la rubrica «Posologia/impiego»).
Non sono disponibili dati per pazienti con insufficienza epatica grave (Child-Pugh C) (cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Disfunzioni renali
Un lieve disturbo della funzionalità renale (clearance della creatinina [CLCR] tra 60 e <90 ml/min) non ha avuto effetti né sull'AUC né sulla Cmax di finerenone. Nel confronto con soggetti con funzionalità renale normale (CLCR ≥90 ml/min), l'effetto di un'insufficienza renale moderata (CLCR tra 30 e <60 ml/min) o grave (CLCR <30 ml/min) sull'AUC di finerenone è stato simile, con incrementi del 34-36%. La presenza di un disturbo della funzionalità renale moderata o grave non ha avuto effetti sulla Cmax (cfr. la rubrica «Posologia/impiego»).
Considerando l'elevato legame con le proteine plasmatiche, è prevedibile che finerenone non sia dializzabile.
Pazienti anziani
Dei 2827 pazienti trattati con finerenone nello studio FIDELIO-DKD, il 58% era di età pari o superiore a 65 anni e il 15% di età pari o superiore a 75 anni. Complessivamente, non è stata osservata alcuna differenza in termini di sicurezza o di efficacia tra questi pazienti e quelli più giovani.
I pazienti anziani (≥65 anni) hanno presentato maggiori concentrazioni plasmatiche di finerenone rispetto ai pazienti giovani (≤45 anni), con valori medi di AUC e Cmax superiori rispettivamente del 34% e del 51% (cfr. la rubrica «Posologia/impiego»).
Peso corporeo
In analisi farmacocinetiche di popolazione il peso corporeo è risultato essere una covariata per Vc/F, determinando maggiori valori della Cmax di finerenone nei soggetti con minor peso corporeo. La Cmax di un individuo con peso corporeo di 50 kg è stata stimata più elevata del 43-51% rispetto a un individuo di 100 kg. Non sono necessari adeguamenti della dose in base al peso corporeo (cfr. la rubrica «Posologia/impiego»).
Dati preclinici
I dati preclinici degli studi convenzionali su farmacologia di sicurezza, tossicità acuta e fototossicità non evidenziano alcun rischio particolare per l'essere umano a concentrazioni clinicamente rilevanti.
Gli effetti osservati negli studi di tossicità per somministrazione ripetuta sono stati prevalentemente riconducibili all'eccessiva attività farmacodinamica di finerenone nonché a reazioni adattive secondarie.
Tossicità per la riproduzione
La fertilità maschile nel ratto non è stata influenzata da dosi fino a 30 mg/kg/die di finerenone (16 volte l'AUCunbound nell'uomo). Finerenone ha causato una riduzione della fertilità nelle femmine di ratto (ridotto numero di corpi lutei e dei siti di impianto) nonché segni di tossicità embrionale precoce (aumento delle perdite post-impianto e ridotto numero di feti vitali) a circa 21 volte l'AUCunbound nell'uomo. A un valore circa 17 volte l'AUCunbound umana è stata inoltre rilevata una riduzione del peso delle ovaie. A 10 volte l'AUCunbound umana, non sono stati osservati effetti sulla fertilità femminile né sul primo sviluppo embrionale.
Negli studi sulla tossicità embriofetale nel ratto, la somministrazione orale di finerenone ha portato a una riduzione del peso della placenta e a segni di tossicità embriofetale, ivi compresi ridotto peso fetale e ritardata ossificazione a partire dalla dose tossico-materna di 10 mg/kg/die, corrispondente a un'AUCunbound 19 volte superiore rispetto all'esposizione clinica. A 30 mg/kg/die, l'incidenza di alterazioni viscerali e scheletriche è risultata aumentata (lieve edema, cordone ombelicale accorciato, fontanella di dimensioni leggermente aumentate), e un feto ha presentato malformazioni complesse compresa una malformazione rara (arco aortico doppio). L'AUCunbound è pari a circa 25 volte l'esposizione clinica. Il NOAEL di 3 mg/kg/die (bassa dose) nel ratto ha fornito un margine di sicurezza corrispondente a 10 volte l'AUCunbound. Nel coniglio, il NOAEL di 2.5 mg/kg/die (dose elevata) ha fornito un margine di sicurezza corrispondente a 13 volte l'AUCunbound.
Nello studio di tossicità per lo sviluppo pre- e postnatale condotto nel ratto sono stati osservati un aumento della mortalità dei cuccioli ed altri rilievi avversi (ridotto peso dei cuccioli, ritardato dispiegamento del padiglione auricolare) dopo la somministrazione di una dose pari o superiore a 3 mg/kg/die. Inoltre, i cuccioli in questi gruppi di dose hanno manifestato un lieve aumento dell'attività locomotoria, senza tuttavia presentare ulteriori alterazioni a livello neurocomportamentale, a partire da un'AUCunbound circa 4 volte superiore rispetto all'esposizione clinica. Il NOAEL di 1 mg/kg/die ha fornito un margine di sicurezza corrispondente a circa 2 volte l'AUCunbound. L'aumentata attività locomotoria nella prole potrebbe essere indicativa di un potenziale rischio per il feto.
Genotossicità
Finerenone non ha indotto mutazioni al test di mutagenesi batterica (test di Ames). Finerenone non ha indotto aberrazioni cromosomiche in cellule polmonari V79 di criceto cinese in vitro. Nel test del micronucleo in vivo su topi maschi, finerenone somministrato per via intraperitoneale non è risultato clastogeno a concentrazioni fino a 1000 mg/kg/die. Complessivamente, finerenone non ha dimostrato potenziale genotossico.
Cancerogenicità
In studi di cancerogenicità di 2 anni, la somministrazione orale di finerenone a ratti maschi e femmine e a topi femmine non ha mostrato alcun potenziale cancerogeno. Nei topi maschi finerenone ha portato ad un incremento di adenomi delle cellule di Leydig dopo la somministrazione di una dose di 30 mg/kg/die, corrispondente a un'AUCunbound 26 volte superiore all'esposizione clinica. Una dose di 10 mg/kg/die, corrispondente a un'AUCunbound pari a 17 volte l'esposizione clinica, non ha causato tumori. In considerazione della nota predisposizione dei roditori allo sviluppo di questi tumori e del meccanismo farmacologico a dosi sovraterapeutiche, nonché degli adeguati margini di sicurezza, l'aumento di tumori delle cellule di Leydig nei topi maschi non è considerato clinicamente rilevante.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Tenere fuori dalla portata dei bambini.
Non conservare a temperature superiori a 30 C.
Conservare nella confezione originale.
Numero dell'omologazione
68130 (Swissmedic).
Titolare dell’omologazione
Bayer (Schweiz) AG, Zurigo
Stato dell'informazione
Agosto 2021
▼ Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave. Voir la rubrique «Effets indésirables» pour les modalités de déclaration des effets secondaires.
Composition
Principes actifs
Finerenonum.
Excipients
Cellulosum microcristallinum, carmellosum natricum conexum, lactosum monohydricum, magnesii stearas, hypromellosum, natrii laurilsulfas.
Enrobage: Hypromellosum, talcum, titanii dioxidum (E 171), ferrum oxydatum rubrum (E 172) (uniquement pour les comprimés dosés à 10 mg), ferrum oxydatum flavum (E 172) (uniquement pour les comprimés dosés à 20 mg).
Un comprimé pelliculé de 10 mg contient 0.44 mg de sodium et 42.75 mg de lactose.
Un comprimé pelliculé de 20 mg contient 0.47 mg de sodium et 38.00 mg de lactose.
Forme pharmaceutique et quantité de principe actif par unité
Comprimés pelliculés à 10 mg et 20 mg de finérénone.
Aspect
10 mg: comprimé pelliculé de couleur rose, de forme ovale, d'une longueur de 10 mm et d'une largeur de 5 mm avec l'inscription «10» sur une face et «FI» sur l'autre face.
20 mg: comprimé pelliculé de couleur jaune, de forme ovale, d'une longueur de 10 mm et d'une largeur de 5 mm avec l'inscription «20» sur une face et «FI» sur l'autre face.
Indications/Possibilités d’emploi
Kerendia est indiqué pour ralentir la progression d'une néphropathie chronique chez des patients adultes atteints de diabète de type 2 (voir les rubriques «Posologie/Mode d'emploi» et «Efficacité clinique»).
Voir la rubrique «Efficacité clinique» pour les résultats d'études concernant les effets sur les événements cardiovasculaires.
Posologie/Mode d’emploi
Posologie usuelle
La dose cible recommandée de Kerendia est de 20 mg une fois par jour (correspondant à la dose journalière maximale).
Instauration du traitement
Kerendia doit être utilisé en complément du traitement standard (voir la rubrique «Efficacité clinique»).
Il est recommandé d'instaurer le traitement par Kerendia lorsque le taux de potassium sérique est ≤4.8 mmol/l. Pour la surveillance du potassium sérique, voir «Traitement d'entretien».
Lorsque le potassium sérique est > 4.8 à 5.0 mmol/l, un traitement par Kerendia peut être envisagé en fonction des caractéristiques du patient et du taux de potassium sérique, auquel cas une surveillance supplémentaire du potassium sérique devrait être mise en place durant les 4 premières semaines (voir la rubrique «Mises en garde et précautions»).
Lorsque le taux de potassium sérique est > 5.0 mmol/l, un traitement par Kerendia n'est pas recommandé (voir la rubrique «Mises en garde et précautions»).
Le débit de filtration glomérulaire estimé (DFGe) est mesuré afin de déterminer la dose initiale. La dose initiale de Kerendia est la suivante:
- 20 mg une fois par jour si le DFGe est ≥60 ml/min/1.73 m2
- 10 mg une fois par jour si le DFGe est ≥25 à < 60 ml/min/1.73 m2
En raison d'une expérience clinique limitée, il n'est pas recommandé d'instaurer un traitement par Kerendia chez les patients avec un DFGe < 25 ml/min/1.73 m2.
Traitement d'entretien
Le potassium sérique et le DFGe doivent à nouveau être mesurés quatre semaines après l'instauration, la reprise ou l'augmentation de la posologie du traitement par Kerendia. Pour décider de la poursuite du traitement par Kerendia et ajuster la posologie, consulter le Tableau 1. Par la suite, l'analyse du potassium sérique doit être à nouveau mesurée périodiquement, et au besoin, en tenant compte des caractéristiques du patient et du taux de potassium sérique (voir les rubriques «Mises en garde et précautions» et «Interactions»).
Tableau 1: Poursuite (4 semaines après l'instauration, la reprise ou l'augmentation de la posologie) du traitement par Kerendia et ajustement posologique
Potassium sérique (mmol/l) | Posologie de Kerendia (à partir de la semaine 5) |
≤4.8 | Maintenir la posologie de 20 mg une fois par jour. Chez les patients traités à une posologie de 10 mg une fois par jour, augmenter la posologie à 20 mg une fois par jour si le DFGe n'a pas diminué de > 30 % par rapport à la mesure précédente. |
> 4.8 à 5.5 | Maintenir la posologie. |
> 5.5 | Interrompre la prise de Kerendia. Reprendre le traitement à une posologie de 10 mg une fois par jour lorsque le potassium sérique est ≤5.0 mmol/l. |
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C), le traitement par Kerendia est à éviter (voir les rubriques «Mises en garde et précautions» et «Pharmacocinétique»).
Chez les patients présentant une insuffisance hépatique légère à modérée, aucun ajustement posologique à l'instauration du traitement n'est nécessaire (Child-Pugh A ou B) (voir la rubrique «Pharmacocinétique»).
Chez les patients présentant une insuffisance hépatique modérée (Child-Pugh B), une surveillance supplémentaire du potassium sérique doit être envisagée et adaptée aux caractéristiques du patient (voir les rubriques «Mises en garde et précautions» et «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Instauration du traitement
Chez les patients ayant un DFGe ≥25 à < 60 ml/min/1.73 m2, la dose initiale de Kerendia est de 10 mg une fois par jour.
En raison d'une expérience clinique limitée, il n'est pas recommandé d'instaurer un traitement par Kerendia chez les patients ayant un DFGe < 25 ml/min/1.73 m2 (voir les rubriques «Mises en garde et précautions» et «Pharmacocinétique»).
Traitement d'entretien
Chez les patients présentant des troubles légers, modérés ou sévères de la fonction rénale, la poursuite du traitement par Kerendia et l'ajustement posologique dépendent du potassium sérique.
Pour déterminer si la dose initiale doit être augmentée jusqu'à la dose journalière recommandée, il convient de déterminer le DFGe 4 semaines après l'instauration du traitement. Voir Tableau 1 et «Traitement d'entretien».
Chez les patients présentant une insuffisance rénale terminale (DFGe < 15 ml/min/1.73 m2), le traitement par Kerendia doit être poursuivi avec prudence en surveillant le taux de potassium sérique, car les données cliniques sont limitées (voir la rubrique «Mises en garde et précautions»).
Traitement associé
Chez tous les patients recevant déjà un inhibiteur modéré du CYP3A4, le traitement par Kerendia doit être instauré avec une dose initiale de 10 mg une fois par jour (voir les rubriques «Mises en garde et précautions» et «Interactions»).
Poids corporel
Aucun ajustement posologique n'est nécessaire en fonction du poids corporel (voir la rubrique «Pharmacocinétique»).
Patients âgés
Aucun ajustement posologique n'est nécessaire en fonction de l'âge (voir la rubrique «Pharmacocinétique»).
Enfants et adolescents
La sécurité et l'efficacité de Kerendia n'ont pas été étudiées chez les patients de moins de 18 ans.
Prise retardée
En cas d'oubli d'une dose, celle-ci doit être prise aussitôt que possible, mais uniquement le jour même. Une dose oubliée ne doit pas être compensée par la prise d'une double dose le jour même.
Mode d'administration
Voie orale.
Les comprimés peuvent être pris avec un verre d'eau indépendamment des repas (voir la rubrique «Pharmacocinétique»).
La prise de Kerendia avec du pamplemousse ou de jus de pamplemousse est à éviter (voir les rubriques «Mises en garde et précautions» et «Interactions»).
Chez les patients qui ne sont pas en mesure d'avaler des comprimés entiers, les comprimés peuvent être écrasés juste avant la prise et mélangés à de l'eau ou à un aliment visqueux (p.ex. compote de pommes) (voir la rubrique «Pharmacocinétique»).
Contre-indications
Kerendia est contre-indiqué chez les patients:
- qui suivent un traitement concomitant par des inhibiteurs puissants du CYP3A4 (p.ex. itraconazole, kétoconazole, ritonavir, nelfinavir, cobicistat, clarithromycine, télithromycine et néfazodone) (voir la rubrique «Interactions»).
- atteints de la maladie d'Addison.
- qui présentent une hypersensibilité au principe actif ou à l'un des excipients (voir les rubriques «Composition» et «Mises en garde et précautions»).
Mises en garde et précautions
Hyperkaliémie
Une hyperkaliémie a été observée chez des patients traités par Kerendia (voir la rubrique «Effets indésirables»).
Certains patients ont un risque accru de développer une hyperkaliémie. Les facteurs de risque comprennent un DFGe diminué, un taux de potassium sérique élevé et des antécédents d'épisodes d'hyperkaliémie. Chez ces patients, il convient d'envisager des contrôles plus fréquents.
Il n'est pas recommandé d'instaurer un traitement par Kerendia lorsque le taux de potassium sérique est > 5.0 mmol/l. Lorsque le potassium sérique est > 4.8 à 5.0 mmol/l, un traitement par Kerendia peut être envisagé en fonction des caractéristiques du patient et du taux de potassium sérique, auquel cas une surveillance supplémentaire du potassium sérique doit être mise en place durant les 4 premières semaines (voir la rubrique «Posologie/Mode d'emploi»).
L'administration de Kerendia doit être interrompue lorsque le taux de potassium sérique est > 5.5 mmol/l. Il convient de respecter les directives locales relatives au traitement de l'hyperkaliémie. Le traitement par Kerendia peut être repris à une posologie de 10 mg une fois par jour lorsque le potassium sérique est ≤5.0 mmol/l (voir la rubrique «Posologie/Mode d'emploi»).
Chez tous les patients, le potassium sérique et le DFGe doivent à nouveau être mesurés quatre semaines après l'instauration, la reprise ou l'augmentation de la posologie du traitement par Kerendia. Par la suite, la mesure du potassium sérique doit être réitérée périodiquement, et au besoin, en tenant compte des caractéristiques du patient et du taux de potassium sérique (voir la rubrique «Posologie/Mode d'emploi»).
Traitement concomitant
Le risque d'hyperkaliémie peut également augmenter lors de la prise de traitements concomitants susceptibles d'élever le taux de potassium sérique (voir la rubrique «Interactions»). Voir également «Utilisation concomitante de substances ayant une influence sur l'exposition à la finérénone».
L'utilisation concomitante de Kerendia avec les médicaments suivants est à éviter:
- Diurétiques d'épargne potassique (p.ex. amiloride, triamtérène)
- Autres antagonistes des récepteurs des minéralocorticoïdes (ARM) (p.ex. éplérénone, esaxérénone, spironolactone, canrénone)
Kerendia doit être utilisé avec prudence et le taux de potassium sérique doit être surveillé lors de la prise concomitante des médicaments suivants:
- Suppléments potassiques
- Triméthoprime ou association triméthoprime-sulfaméthoxazole Une interruption temporaire du traitement par Kerendia peut être nécessaire.
Troubles de la fonction rénale
Le risque d'hyperkaliémie augmente avec le déclin de la fonction rénale. Au besoin, une surveillance continue de la fonction rénale doit être mise en place conformément à la pratique standard (voir la rubrique «Posologie/Mode d'emploi»).
En raison d'une expérience clinique limitée, il n'est pas recommandé d'instaurer un traitement par Kerendia chez les patients ayant un DFGe < 25 ml/min/1.73 m2 (voir les rubriques «Posologie/Mode d'emploi» et «Pharmacocinétique»).
En raison d'une expérience clinique limitée, le traitement par Kerendia doit être poursuivi avec prudence en surveillant le taux de potassium sérique chez les patients présentant une insuffisance rénale terminale (DFGe < 15 ml/min/1.73 m2) (voir la rubrique «Posologie/Mode d'emploi»).
Troubles de la fonction hépatique
Les patients présentant une insuffisance hépatique sévère (Child-Pugh C) n'ont pas fait l'objet d'études (voir la rubrique «Pharmacocinétique»). Une augmentation importante de l'exposition à la finérénone étant attendue, l'utilisation de Kerendia chez les patients présentant une insuffisance hépatique sévère est à éviter (voir la rubrique «Posologie/Mode d'emploi»).
En raison d'une augmentation de l'exposition à la finérénone, chez les patients présentant une insuffisance hépatique modérée (Child-Pugh B), une surveillance supplémentaire du potassium sérique doit être envisagée et être adaptée aux caractéristiques du patient (voir les rubriques «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Utilisation concomitante de substances ayant une influence sur l'exposition à la finérénone
Inhibiteurs faibles et modérés du CYP3A4
Lorsque Kerendia est utilisé en concomitance avec des inhibiteurs modérés du CYP3A4 (p.ex. érythromycine et vérapamil) ou des inhibiteurs faibles du CYP3A4 (p.ex. amiodarone et fluvoxamine), une augmentation de l'exposition à la finérénone est attendue (voir la rubrique «Interactions»). Par conséquent, le taux de potassium sérique est à surveiller, en particulier à l'instauration du traitement par Kerendia ou en cas de modifications de la posologie de Kerendia ou de l'inhibiteur du CYP3A4 (voir la rubrique «Posologie/Mode d'emploi»).
Inducteurs modérés et puissants du CYP3A4
L'utilisation concomitante de Kerendia avec des inducteurs puissants du CYP3A4 (p.ex. rifampicine, carbamazépine, phénytoïne, phénobarbital, millepertuis) ou des inducteurs modérés du CYP3A4 (p.ex. éfavirenz), qui abaissent fortement les concentrations plasmatiques de finérénone et entraînent une réduction de l'effet thérapeutique, est à éviter (voir la rubrique «Interactions»). Le recours à un autre traitement concomitant sans effet inducteur ou à effet inducteur faible sur le CYP3A4 doit être envisagé.
Pamplemousse
La prise concomitante de pamplemousse ou de jus de pamplemousse est à éviter, car celle-ci augmente la concentration plasmatique de la finérénone (voir les rubriques «Posologie/Mode d'emploi» et «Interactions»).
Informations sur les excipients
Kerendia contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Kerendia contient du sodium. Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu'il est essentiellement «sans sodium».
Interactions
Des études d'interaction ont uniquement été menées chez l'adulte. La finérénone est presque exclusivement éliminée par le métabolisme oxydatif médié par les cytochromes P450 (CYP) (principalement par le CYP3A4 [90 %] et dans une faible proportion par le CYP2C8 [10 %]).
Effet d'autres médicaments sur Kerendia
Inhibiteurs enzymatiques
Inhibiteurs puissants du CYP3A4
L'utilisation concomitante de Kerendia avec l'itraconazole, la clarithromycine et d'autres inhibiteurs puissants du CYP3A4 (p.ex. kétoconazole, ritonavir, nelfinavir [non autorisé en Suisse], cobicistat, télithromycine [non autorisée en Suisse] ou néfazodone [non autorisée en Suisse]) est contre-indiquée, car une hausse importante de l'exposition à la finérénone est attendue (voir la rubrique «Contre-indications»). Les simulations montrent que l'utilisation concomitante de Kerendia avec l'itraconazole (200 mg deux fois par jour) augmente l'exposition à la finérénone (rapport des moyennes géométriques [RMG] et intervalle de population à 90 % pour l'ASC et la Cmax: 6.31 [3.36 à 11.41] et 2.37 [1.76 à 3.31]). La clarithromycine (500 mg deux fois par jour) a également entraîné une hausse de l'exposition à la finérénone conforme aux attentes (RMG et intervalle de population à 90 % pour l'ASC et la Cmax: 5.28 [2.88 à 10.48] et 2.25 [1.76 à 2.98]).
Inhibiteurs modérés du CYP3A4
L'utilisation concomitante de l'érythromycine (500 mg trois fois par jour), un inhibiteur modéré du CYP3A4, a augmenté l'exposition moyenne à la finérénone (RMG et intervalle de confiance à 90 % pour l'ASC et la Cmax: 3.48 [3.02 à 4.02] et 1.88 [1.63 à 2.17]). L'utilisation concomitante d'un autre inhibiteur modéré du CYP3A4, le vérapamil (comprimé de 240 mg à libération prolongée, une fois par jour) a augmenté l'exposition moyenne à la finérénone (RMG et intervalle de confiance à 90 % pour l'ASC et la Cmax: 2.70 [2.43 à 3.01] et 2.22 [1.88 à 2.62]). Ceci pouvant entraîner une augmentation du potassium sérique, le taux de potassium sérique est à surveiller (voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Inhibiteurs faibles du CYP3A4
Les simulations indiquent que la fluvoxamine (100 mg deux fois par jour), un inhibiteur faible du CYP3A4, augmente l'exposition à la finérénone (RMG et intervalle de population à 90 % pour l'ASC et la Cmax: 1.57 [1.25 à 2.08] et 1.38 [1.18 à 1.64]). Ceci pouvant entraîner une augmentation du potassium sérique, le taux de potassium sérique est à surveiller (voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Pamplemousse
La prise concomitante de pamplemousse ou de jus de pamplemousse augmente vraisemblablement la concentration plasmatique de la finérénone et est à éviter (voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Inducteurs enzymatiques
L'utilisation concomitante de Kerendia avec la rifampicine et d'autres inducteurs puissants du CYP3A4 (p.ex. carbamazépine, phénytoïne, phénobarbital, millepertuis) ou avec l'éfavirenz et d'autres inducteurs modérés du CYP3A4 n'est pas recommandée. Ces inducteurs du CYP3A4 font nettement baisser les concentrations plasmatiques de finérénone et entraînent une réduction de l'effet thérapeutique (voir la rubrique «Mises en garde et précautions»).
Les simulations indiquent que la rifampicine (600 mg une fois par jour), un inducteur puissant du CYP3A4, diminue l'exposition à la finérénone (RMG et intervalle de population à 90 % pour l'ASC et la Cmax: 0.07 [0.05 à 0.11] et 0.14 [0.11 à 0.21]). L'éfavirenz (600 mg une fois par jour), un inducteur modéré du CYP3A4, diminue l'exposition à la finérénone (RMG et intervalle de population à 90 % pour l'ASC et la Cmax: 0.19 [0.14 à 0.27] et 0.32 [0.23 à 0.43]).
Interactions pharmacodynamiques
Médicaments qui augmentent le taux de potassium sérique
Il faut s'attendre à ce que les médicaments qui augmentent le taux de potassium sérique accroissent le risque d'hyperkaliémie en cas d'utilisation concomitante avec Kerendia.
L'utilisation concomitante de Kerendia avec les médicaments suivants doit être évitée:
- Diurétiques d'épargne potassique (p.ex. amiloride, triamtérène [non autorisé en Suisse])
- Autres antagonistes des récepteurs des minéralocorticoïdes (ARM) (p.ex. éplérénone, spironolactone, esaxérénone [non autorisée en Suisse], canrénone [non autorisée en Suisse])
Lorsqu'il est associé avec les médicaments suivants, Kerendia doit être utilisé avec prudence et le taux de potassium sérique doit faire l'objet d'une surveillance durant le traitement:
- Suppléments potassiques
- Triméthoprime ou association triméthoprime-sulfaméthoxazole. Une interruption temporaire du traitement par Kerendia peut être nécessaire (voir la rubrique «Mises en garde et précautions»).
Effet de Kerendia sur d'autres médicaments
In vivo, un schéma à doses multiples de 20 mg de finérénone une fois par jour n'avait aucun effet sur l'ASC du midazolam utilisé comme substrat témoin du CYP3A4. L'activité du CYP3A4 n'est ni inhibée ni induite par la finérénone.
Une dose unique de 20 mg de finérénone n'avait pas non plus d'effet sur l'ASC et sur la Cmax du répaglinide utilisé comme substrat témoin du CYP2C8. L'activité du CYP2C8 n'est pas inhibée par la finérénone.
Aucune interaction pharmacocinétique réciproque entre la finérénone et la warfarine, un substrat du CYP2C9, ainsi qu'entre la finérénone et la digoxine, un substrat de la P-gp, n'a été mise en évidence.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes qui pourraient être enceintes doivent utiliser un moyen de contraception efficace pendant le traitement par Kerendia.
Grossesse
Il n'existe pas de données relatives à l'utilisation de Kerendia chez la femme enceinte. Les études chez l'animal ont révélé une toxicité sur le développement embryofœtal après des expositions qui étaient supérieures à l'exposition maximale chez l'être humain (voir la rubrique «Données précliniques»).
Kerendia ne doit pas être utilisé pendant la grossesse sauf si l'état clinique de la patiente nécessite un traitement par la finérénone.
Allaitement
On ignore si la finérénone ou ses métabolites passent dans le lait maternel humain. Les données pharmacocinétiques et toxicologiques disponibles chez l'animal ont montré que la finérénone et ses métabolites sont excrétés dans le lait (voir la rubrique «Données précliniques»). Un risque ne peut être exclu pour les nouveau-nés et les enfants en bas âge allaités. Une décision doit être prise soit d'interrompre l'allaitement soit d'interrompre le traitement par Kerendia, en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Il n'existe aucune donnée relative aux effets de Kerendia sur la fertilité humaine. Les études chez l'animal n'ont pas fourni d'indices cliniquement pertinents quant à un risque d'altération de la fertilité par la finérénone (voir la rubrique «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Sur la base du profil de sécurité de Kerendia, aucune influence sur l'aptitude à la conduite ou l'utilisation de machines n'est attendue.
Effets indésirables
Résumé du profil de sécurité
La sécurité de Kerendia chez les patients présentant une néphropathie chronique et un diabète de type 2 a été évaluée dans l'étude pivot de phase III FIDELIO-DKD. Dans cette étude, 2 827 patients ont reçu Kerendia (10 mg ou 20 mg une fois par jour) et 2 831 un placebo. Chez les patients du groupe Kerendia, la durée moyenne du traitement était de 2.2 années.
L'effet indésirable le plus fréquemment rapporté (≥10 %) pour Kerendia était l'hyperkaliémie (voir «Description d'effets indésirables spécifiques» ci-dessous et la rubrique «Mises en garde et précautions»).
Liste des effets indésirables
Les effets indésirables observés avec Kerendia sont récapitulés dans le Tableau 2 ci-dessous par classe de système d'organes MedDRA et par catégorie de fréquence. Les effets indésirables sont rangés par classe de système d'organes et par fréquence décroissante selon la convention suivante: très fréquents (≥1/10), fréquents (≥1/100 à < 1/10), occasionnels (≥1/1000 à < 1/100), rares (≥1/10 000 à < 1/1000), très rares (< 1/10 000).
Tableau 2: Effets indésirables
Classe de système d'organe MedDRA | Très fréquents | Fréquents |
Troubles du métabolisme et de la nutrition | Hyperkaliémie1 | Hyponatrémie2 |
Affections vasculaires | Hypotension3, 4 | |
Investigations | Débit de filtration glomérulaire diminué5 | |
1 Comprend un taux de potassium sanguin élevé et une hyperkaliémie 2 Comprend un taux de sodium sanguin diminué et une hyponatrémie 3 Comprend une pression artérielle réduite, une pression artérielle diastolique réduite, une hypotension diastolique et une hypotension 4 Chez les patients traités par Kerendia, la pression artérielle systolique (PAS) moyenne a baissé après 1 mois de 3 mmHg et la pression artérielle diastolique (PAD) moyenne de 1 à 2 mmHg puis s'est stabilisée. La majorité des événements d'hypotension étaient d'intensité légère à modérée et ont disparu spontanément. Les événements associés à une hypotension, tels que vertiges, syncope ou chute, ne sont pas survenus plus fréquemment sous Kerendia que sous placebo. 5 Une baisse initiale du DFGe (en moyenne de 2 ml/min/1.73 m2) s'est atténuée au fil du temps comparativement au placebo. À l'arrêt du traitement, cette baisse s'est avérée réversible (voir la rubrique «Propriétés/Effets»). | ||
Description d'effets indésirables spécifiques
Hyperkaliémie
Dans l'étude FIDELIO-DKD, des événements d'hyperkaliémie ont été rapportés chez 18.3 % des patients traités par Kerendia, contre 9.0 % des patients recevant le placebo. Chez les patients traités par Kerendia, la majorité des événements d'hyperkaliémie étaient d'intensité légère à modérée. La proportion des hospitalisations pour hyperkaliémie était de 1.4 % dans le groupe finérénone contre 0.3 % dans le groupe placebo. La fréquence des hyperkaliémies ayant entraîné un arrêt définitif du médicament étudié était de 2.3 % chez les patients sous finérénone contre 0.9 % dans le groupe placebo.
Une augmentation du taux moyen de potassium sérique d'environ 0.2 mmol/l par rapport à la valeur de départ a été observée durant le premier mois de traitement dans le bras Kerendia par rapport au placebo et la différence maximale observée entre les deux groupes était de 0.23 mmol/l après 4 mois; cette différence s'est ensuite stabilisée (voir la rubrique «Propriétés/Effets»). Pour des recommandations spécifiques, voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun événement indésirable en lien avec un surdosage de Kerendia n'a été rapporté à ce jour chez l'être humain. Il est attendu que le signe le plus probable d'un surdosage soit une hyperkaliémie. Si une hyperkaliémie survient, le traitement standard doit être instauré conformément aux directives locales. Le traitement par Kerendia doit être poursuivi conformément au Tableau 1 (voir la rubrique «Posologie/Mode d'emploi»).
Il est peu probable que la finérénone soit éliminée efficacement par hémodialyse, car la fraction liée aux protéines plasmatiques est d'environ 90 %.
Propriétés/Effets
Code ATC
C03DA05
Mécanisme d'action
La finérénone est un antagoniste sélectif non stéroïdien du récepteur des minéralocorticoïdes (RM) et atténue efficacement l'inflammation et la fibrose induites par une hyperactivation du RM. Le RM est exprimé dans les reins, le cœur et les vaisseaux sanguins, où la finérénone agit également contre la rétention de sodium et les processus hypertrophiques. Compte tenu de sa structure non stéroïdienne et de son mode de liaison massif, la finérénone est très puissante et a une haute sélectivité pour le RM. La finérénone n'a aucune affinité pertinente pour les récepteurs des androgènes, de la progestérone, des œstrogènes et des glucocorticoïdes et n'occasionne par conséquent aucun effet secondaire lié aux hormones sexuelles (gynécomastie p. ex.). Sa liaison au RM donne lieu à un complexe récepteur-ligand spécifique qui bloque le recrutement des coactivateurs de transcription qui participent à l'expression des médiateurs pro-inflammatoires et profibrotiques.
Pharmacodynamique
Effets chez les sujets sains
La finérénone (doses multiples de 10 mg et 20 mg deux fois par jour ou 40 mg une fois par jour pendant 10 jours) n'avait pas d'effet durable sur la natriurèse ni sur le potassium urinaire chez les sujets masculins sains. Ces schémas posologiques ont entraîné une activation du système rénine-angiotensine-aldostérone (SRAA), c.-à-d. des hausses réversibles de l'activité rénine plasmatique et des concentrations sériques d'aldostérone, avec un retour aux valeurs de départ dans les 48 heures suivant l'administration de la dernière dose.
Après l'activation du RM par l'antagoniste du RM fludrocortisone (0.5 mg), la finérénone (doses uniques de solution de PEG à 2.5, 5, 10, 20 mg ou comprimés de 20 mg) a toutefois mis en évidence des effets natriurétiques dose-dépendants chez les sujets masculins sains. En outre, la finérénone (à des doses de 5 à 20 mg) a abaissé considérablement l'excrétion de potassium dans les urines par rapport au placebo.
Des doses multiples ou uniques de finérénone n'ont pas eu d'effets sur les signes vitaux chez les sujets sains.
Effets chez les patients présentant une néphropathie chronique et un diabète de type 2
Dans l'étude FIDELIO-DKD, une étude de phase III randomisée, en double aveugle, contrôlée contre placebo, multicentrique, menée chez des adultes présentant une néphropathie chronique et un diabète de type 2, la réduction relative du rapport albuminurie/créatininurie (RAC) corrigée par rapport au placebo chez les patients qui avaient été affectés par randomisation au groupe finérénone était de 31 % après 4 mois et le RAC est resté à un niveau inférieur pendant toute la durée de l'étude.
Électrophysiologie cardiaque
Une étude QT approfondie portant sur 57 sujets sains n'a mis en évidence aucun indice d'effet d'allongement de l'intervalle QT/QTc de la finérénone après des doses uniques de 20 mg (doses thérapeutiques) ou de 80 mg (doses suprathérapeutiques), ce qui indique que la finérénone n'a aucun effet sur la repolarisation cardiaque.
Efficacité clinique
L'étude FIDELIO-DKD était une étude de phase III randomisée, en double aveugle, contrôlée contre placebo, multicentrique qui portait sur l'effet de la finérénone par rapport au placebo sur les événements rénaux et cardiovasculaires chez des patients adultes présentant un diabète de type 2 et une néphropathie chronique (critères d'inclusion: a) albuminurie modérée [RAC ≥30 à < 300 mg/g] et DFGe 25 à 60 ml/min/1.73 m2 avec présence concomitante d'une rétinopathie diabétique OU b) d'albuminurie sévère [RAC ≥300 mg/g] et DFGe 25 à 75 ml/min/1.73 m2). Les patients inclus dans l'étude devaient présenter un taux de potassium sérique ≤4.8 mmol/l et avoir reçu un traitement préalable par une thérapie standard, y compris une dose maximale tolérée d'un inhibiteur de l'enzyme de conversion de l'angiotensine (inhibiteur de l'ECA [34 %]) ou d'un antagoniste des récepteurs de l'angiotensine (ARA [66 %]). Les patients qui présentaient une insuffisance cardiaque chronique de classe NYHA II à IV étaient exclus de l'étude.
Le critère d'évaluation primaire de l'étude FIDELIO-DKD était un critère composite constitué du délai jusqu'à la survenue d'une défaillance rénale (définie par une dialyse chronique, une transplantation rénale ou une baisse du DFGe à < 15 ml/min/1.73 m2 pendant au moins 4 semaines), de la baisse du DFGe de ≥40 % par rapport à la valeur de départ pendant au moins 4 semaines ou du décès d'origine rénale. Le critère d'évaluation secondaire était un critère cardiovasculaire composite constitué du délai jusqu'à la survenue d'un décès cardiovasculaire (CV), d'un infarctus du myocarde (IM) non mortel, d'un accident vasculaire cérébral (AVC) non mortel ou d'une hospitalisation pour insuffisance cardiaque.
L'étude évaluait 5 674 patients qui ont été randomisés selon un rapport de 1/1 en vue de recevoir la finérénone une fois par jour (n = 2 833) ou le placebo (n = 2 841). La dose initiale était soit de 10 mg [si DFGe compris entre 25 et < 60 ml/min/1.73 m2], soit de 20 mg [si DFGe ≥60 ml/min/1.73 m2]. Le dosage a été ajusté à 10 mg ou 20 mg une fois par jour au cours de l'étude, principalement en raison du taux de potassium sérique. La durée de suivi médiane était de 2.6 années. La population de l'étude était composée à 63 % de Blancs, à 25 % d'Asiatique et à 5 % de Noirs. L'âge moyen au moment du recrutement était de 66 ans, et 70 % des patients étaient de sexe masculin. Le DFGe moyen à l'inclusion était de 44.3 ml/min/1.73 m2 et 55 % des patients avaient un DFGe < 45 ml/min/1.73 m2. Le RAC médian était de 852 mg/g, le taux moyen d'hémoglobine glyquée A1c (HbA1c) était de 7.7 %. Environ 46 % des participants de l'étude présentaient une athérosclérose cardiovasculaire préexistante, 30 % une coronaropathie et 8 % des antécédents d'insuffisance cardiaque. La tension artérielle moyenne était de 138/76 mmHg. Le délai moyen écoulé entre le diagnostic de diabète de type 2 et l'inclusion dans l'étude était de 16.6 années et, au début de l'étude, la quasi-totalité des participants (97 %) recevait un ou plusieurs antidiabétiques (insuline [64 %], biguanides [44 %], agonistes du récepteur du glucagon-like-peptide-1 [GLP-1] [7 %], inhibiteurs du cotransporteur sodium-glucose de type 2 [SGLT2] [5 %]). De plus, au début de l'étude, respectivement 47 % et 26 % des patients présentaient une rétinopathie diabétique préexistante et une neuropathie diabétique préexistante. La majorité des patients avaient reçu en complément une statine (74 %) et/ou un antagoniste du calcium (63 %).
L'étude FIDELIO-DKD a mis en évidence une supériorité du traitement par la finérénone par rapport au placebo pour le critère d'évaluation primaire (rénal) composite (HR 0.82, IC à 95 % 0.73 à 0.93, p = 0.0014; voir Tableau 3 et Figure 1).
De plus, la finérénone a réduit significativement le risque pour le critère d'évaluation secondaire (cardiovasculaire) composite (HR 0.86, IC à 95 % 0.75 à 0.99, p = 0.0339; voir Tableau 3 et Figure 2). Dans le bras finérénone, les taux d'incidence de l'insuffisance cardiaque, de l'infarctus du myocarde non mortel et du décès d'origine cardiovasculaire étaient inférieurs à ceux du bras placebo. Des AVC non mortels sont survenus dans les deux bras de traitement à une incidence comparable (voir Tableau 3).
Tableau 3: Analyse du critère d'évaluation primaire et des principaux critères d'évaluation secondaire (et de ses composantes) de l'étude de phase III FIDELIO-DKD
Patients atteints de néphropathie chronique et de diabète de type 2 | ||||||
Finérénone* | Placebo* | Effet du traitement | ||||
Critères d'évaluation primaire et secondaires de l'étude | n (%) | Taux d'événements | n (%) | Taux d'événements | Hazard ratio (IC à 95 %) | Valeur p |
Critère d'évaluation primaire composite «Défaillance rénale, baisse durable du DFGe ≥40 % ou décès d'origine rénale» | 504 (17.8 %) | 7.59 | 600 (21.1 %) | 9.08 | 0.82 [0.73; 0.93] | 0.0014 |
Défaillance rénale | 208 (7.3 %) | 2.99 | 235 (8.3 %) | 3.39 | 0.87 [0.72; 1.05] | - |
Baisse durable du DFGe ≥40 % | 479 (16.9 %) | 7.21 | 577 (20.3 %) | 8.73 | 0.81 [0.72; 0.92] | - |
Décès d'origine rénale | 2 (< 0.1 %) | - | 2 (< 0.1 %) | - | - | - |
Critère d'évaluation secondaire composite «Décès CV, IM non mortel, AVC non mortel ou hospitalisation pour insuffisance cardiaque» | 367 (13.0 %) | 5.11 | 420 (14.8 %) | 5.92 | 0.86 [0.75; 0.99] | 0.0339 |
Décès CV | 128 (4.5 %) | 1.69 | 150 (5.3 %) | 1.99 | 0.86 [0.68; 1.08] | - |
IM non mortel | 70 (2.5 %) | 0.94 | 87 (3.1 %) | 1.17 | 0.80 [0.58; 1.09] | - |
AVC non mortel | 90 (3.2 %) | 1.21 | 87 (3.1 %) | 1.18 | 1.03 [0.76; 1.38] | - |
Hospitalisation pour insuffisance cardiaque | 139 (4.9 %) | 1.89 | 162 (5.7 %) | 2.21 | 0.86 [0.68; 1.08] | - |
* Traitement en plus de doses maximales tolérées autorisées d'inhibiteur de l'ECA ou d'ARA.
Figure 1: Délai jusqu'à la survenue d'une défaillance rénale, d'une baisse durable du DFGe ≥40 % vs valeur de départ ou d'un décès d'origine rénale dans l'étude FIDELIO-DKD

Figure 2: Délai jusqu'à la survenue d'un décès CV, d'un IM non mortel, d'un AVC non mortel ou d'une hospitalisation pour insuffisance cardiaque dans l'étude FIDELIO-DKD

Pharmacocinétique
Absorption
Après administration orale, la finérénone est absorbée pratiquement en totalité. L'absorption est rapide et les concentrations plasmatiques maximales (Cmax) sont atteintes 0.5 à 1.25 heure après la prise à jeun du comprimé. La biodisponibilité absolue de la finérénone est de 43.5 % en raison d'un effet de premier passage intestinal et hépatique. In vivo, la finérénone n'est pas un substrat du transporteur d'efflux P-gp.
La prise avec des aliments à haute teneur lipidique et calorique a augmenté l'ASC de la finérénone de 21 %, a réduit la Cmax de 19 % et a allongé le délai nécessaire pour atteindre la Cmax, porté à 2.5 heures. Cet effet n'est pas cliniquement pertinent. Par conséquent, la finérénone peut être prise indépendamment des repas (voir la rubrique «Posologie/Mode d'emploi»).
Distribution
Le volume de distribution de la finérénone à l'état d'équilibre (Vss) est de 52.6 l. In vitro, le taux de liaison aux protéines plasmatiques humaines de la finérénone est de 91.7 %; la protéine de liaison principale est l'albumine sérique.
Métabolisme
Environ 90 % du métabolisme de la finérénone est médié par le CYP3A4 et 10 % par le CYP2C8. Quatre métabolites principaux (M-1a, M-1b, M-2a et M-3a) ont été mis en évidence dans le plasma. Tous les métabolites sont pharmacologiquement inactifs.
Élimination
La finérénone est rapidement éliminée du plasma, avec une demi-vie d'élimination (t1/2) d'environ 2 à 3 heures. L'excrétion de la finérénone sous forme inchangée constitue une voie d'excrétion secondaire (< 1 % de la dose dans les urines par filtration glomérulaire, < 0,2 % dans les selles). Environ 80 % de la dose administrée sont excrétés via les urines et environ 20 % de la dose via les selles, et ce en quasi-totalité sous forme de métabolites. Avec une clairance systémique de l'ordre de 25 l/h, la finérénone constitue un principe actif de faible clairance.
Linéarité/non-linéarité
La pharmacocinétique de la finérénone est linéaire sur la plage de dose étudiée de 1.25 à 80 mg.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Chez les patients cirrhotiques présentant une insuffisance hépatique légère (Child-Pugh A), aucune modification de l'exposition à la finérénone n'a été observée.
Chez les patients cirrhotiques présentant une insuffisance hépatique modérée (Child-Pugh B), l'ASC moyenne de la finérénone a augmenté de 38 % et la Cmax était inchangée par rapport aux sujets témoins sains (voir la rubrique «Posologie/Mode d'emploi»).
Aucune donnée n'est disponible chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Troubles de la fonction rénale
Un trouble de la fonction rénale léger (clairance de la créatinine [CLCR] 60 à < 90 ml/min) n'avait aucune influence sur l'ASC et la Cmax de la finérénone. Par rapport aux sujets ayant une fonction rénale normale (CLCR ≥90 ml/min), l'effet d'une insuffisance rénale modérée (CLCR 30 à < 60 ml/min) ou sévère (CLCR < 30 ml/min) sur l'ASC de la finérénone se situait à des niveaux similaires, avec des hausses de 34 à 36 %. Un trouble de la fonction rénale modéré ou sévère n'avait pas d'effet sur la Cmax (voir la rubrique «Posologie/Mode d'emploi»).
Étant donné sa forte liaison aux protéines plasmatiques, la finérénone n'est probablement pas dialysable.
Patients âgés
58 % des 2 827 patients qui ont reçu la finérénone dans le cadre de l'étude FIDELIO-DKD étaient âgés de 65 ans ou plus et 15 % de 75 ans ou plus. Dans l'ensemble, aucune différence quant à la sécurité ou l'efficacité du médicament n'a été observée entre ces patients et les patients plus jeunes.
Les patients âgés (≥65 ans) présentaient des concentrations plasmatiques de finérénone supérieures à celles des patients plus jeunes (≤45 ans), avec des valeurs moyennes d'ASC et de Cmax supérieures respectivement de 34 % et 51 % chez les patients âgés (voir la rubrique «Posologie/Mode d'emploi»).
Poids corporel
Dans des analyses pharmacocinétiques de populations, le poids corporel s'est avéré être une covariante de Vc/F, ce qui a entraîné des valeurs de Cmax supérieures chez les sujets d'un poids corporel plus faible. La Cmax d'une personne d'un poids corporel de 50 kg était estimée comme étant 43 % à 51 % supérieure à celle d'une personne de 100 kg. Aucun ajustement posologique n'est nécessaire en fonction du poids corporel (voir la rubrique «Posologie/Mode d'emploi»).
Données précliniques
Les données précliniques issues des études conventionnelles sur la pharmacologie de sécurité, la toxicité aiguë et la phototoxicité n'ont pas révélé de risque particulier pour l'homme aux concentrations cliniquement pertinentes.
Les effets qui ont été observés dans les études de toxicité en cas d'administration répétée étaient principalement dus à une exacerbation des activités pharmacodynamiques de la finérénone et à des réactions adaptatives secondaires.
Toxicité sur la reproduction
Chez le rat, la fertilité chez le mâle n'a pas été affectée par des doses de finérénone allant jusqu'à 30 mg/kg/jour (16 fois l'ASCnon liée chez l'être humain). La finérénone a entraîné une baisse de la fertilité chez la ratte (baisse du nombre de corps jaunes et des sites d'implantation) ainsi que des signes d'embryotoxicité précoce (pertes post-implantation accrues et baisse du nombre de fœtus viables) à des doses équivalant à environ 21 fois l'ASCnon liée chez l'être humain. Par ailleurs, à des doses équivalant à environ 17 fois l'ASCnon liée chez l'être humain, une diminution du poids des ovaires a été constatée. À des doses équivalant à 10 fois l'ASCnon liée chez l'être humain, aucun effet n'a été observé sur la fertilité chez la femelle ni sur le développement embryonnaire précoce.
Dans les études portant sur la toxicité embryofœtale chez le rat, l'administration orale de finérénone a entraîné une diminution du poids placentaire et des signes de toxicité embryofœtale dont une réduction du poids fœtal et un retard de l'ossification à partir de la dose toxique maternelle de 10 mg/kg/jour, correspondant à une ASCnon liée 19 fois supérieure à l'exposition clinique. À 30 mg/kg/jour, l'incidence des variations viscérales et squelettiques (léger œdème, cordon ombilical raccourci, fontanelle légèrement plus volumineuse) était accrue, et un fœtus présentait des malformations complexes dont une malformation rare (double arc aortique). L'ASCnon liée était environ 25 fois supérieure à l'exposition clinique. La NOAEL de 3 mg/kg/jour (dose faible) chez le rat a permis d'établir une marge de sécurité qui équivalait à 10 fois l'ASCnon liée. Chez le lapin, la NOAEL de 2.5 mg/kg/jour (dose élevée) a permis d'établir une marge de sécurité qui équivalait à 13 fois l'ASCnon liée.
Dans l'étude sur la toxicité sur le développement prénatal et postnatal chez le rat, une mortalité accrue des ratons et d'autres effets indésirables (ratons de poids plus faible, retard du déploiement du pavillon de l'oreille) ont été observés à une dose à partir de 3 mg/kg/jour. De plus, les ratons de ces groupes de doses présentaient une activité locomotrice légèrement accrue, mais aucune autre altération neuro-comportementale à partir d'une ASCnon liée environ 4 fois supérieure à l'exposition clinique. La NOAEL de 1 mg/kg/jour a permis d'établir une marge de sécurité équivalant à environ 2 fois l'ASCnon liée. L'augmentation de l'activité locomotrice chez les descendants pourrait indiquer un risque potentiel pour le fœtus.
Génotoxicité
La finérénone n'a pas induit de mutations lors du test de mutagenèse sur des souches bactériennes (test d'Ames). In vitro, la finérénone n'a pas induit d'aberrations chromosomiques dans les cellules pulmonaires V79 de hamster chinois. Au test du micronoyau pratiqué in vivo chez des souris mâles, la finérénone administrée par voie intrapéritonéale n'était pas clastogène à des concentrations allant jusqu'à 1 000 mg/kg/jour. Dans l'ensemble, il n'a pas été mis en évidence de potentiel génotoxique de la finérénone.
Carcinogénicité
Dans des études de carcinogénicité de 2 ans, une administration de finérénone par voie orale n'a pas mis en évidence de potentiel carcinogène chez les rats mâles et femelles ainsi que chez les souris femelles. Chez les souris mâles, la finérénone a entraîné une augmentation des adénomes à cellules de Leydig à une dose de 30 mg/kg/jour qui correspondait à une ASCnon liée 26 fois supérieure à l'exposition clinique. Une dose de 10 mg/kg/jour qui correspondait à une ASCnon liée 17 fois supérieure à l'exposition clinique n'a pas provoqué de tumeurs. Sachant que les rongeurs sont prédisposés à développer ces tumeurs et compte tenu du mécanisme pharmacologique aux doses suprathérapeutiques et des marges de sécurité suffisantes, l'incidence accrue de tumeurs à cellules de Leydig chez les souris mâles n'est pas considérée comme étant cliniquement pertinente.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Ne pas conserver au-dessus de 30°C.
Conserver dans l'emballage d'origine.
Numéro d’autorisation
68130 (Swissmedic).
Titulaire de l’autorisation
Bayer (Schweiz) AG, Zurich
Mise à jour de l’information
Août 2021
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.



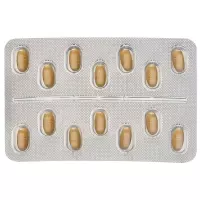
 Deutsch
Deutsch French
French Italian
Italian